10.5: Sólidos
- Page ID
- 74779
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir las propiedades generales de un sólido.
- Describir los seis tipos diferentes de sólidos.
Un sólido es como un líquido en que las partículas están en contacto entre sí. Los sólidos son diferentes a los líquidos en que las fuerzas intermoleculares son lo suficientemente fuertes como para mantener las partículas en su lugar. A temperaturas suficientemente bajas, todas las sustancias son sólidas (el helio es la única excepción), pero la temperatura a la que el estado sólido se convierte en la fase estable varía ampliamente entre las sustancias, desde 20 K (−253°C) para el hidrógeno hasta más de 3,900 K (3,600°C) para el carbono.
La fase sólida tiene varias características. Primero, los sólidos mantienen su forma. No llenan todos sus contenedores como lo hacen los gases, y no adoptan la forma de sus recipientes como lo hacen los líquidos. No se pueden comprimir fácilmente como los gases, y tienen densidades relativamente altas.
Los sólidos también pueden demostrar una variedad de propiedades. Por ejemplo, muchos metales pueden ser golpeados en láminas delgadas o estirados en alambres, mientras que compuestos como el NaCl se romperán si se golpean. Algunos metales, como el sodio y el potasio, son bastante blandos, mientras que otros, como el diamante, son muy duros y pueden rayar fácilmente otras sustancias. Las apariencias también difieren: la mayoría de los metales son brillantes y plateados, pero el azufre (un no metal) es amarillo, y los compuestos iónicos pueden tomar un arco iris de colores. Los metales sólidos conducen la electricidad y el calor, mientras que los sólidos iónicos no. Muchos sólidos son opacos, pero algunos son transparentes. Algunos se disuelven en agua, pero otros no. La figura\(\PageIndex{1}\) muestra dos sólidos que ejemplifican las propiedades similares y disímiles de los sólidos.

Los sólidos pueden tener una amplia variedad de propiedades físicas. Revisaremos los diferentes tipos de sólidos y la unión que les da sus propiedades.
Primero, debemos distinguir entre dos tipos generales de sólidos. Un sólido amorfo es un sólido sin estructura ni repetición a largo plazo. Los ejemplos incluyen el vidrio y muchos plásticos, ambos compuestos por largas cadenas de moléculas sin orden de una molécula a la siguiente. Un sólido cristalino es un sólido que tiene una estructura tridimensional regular y repetitiva. Un cristal de NaCl (Figura\(\PageIndex{1}\)) es un ejemplo: a nivel atómico, el NaCl está compuesto por una matriz tridimensional regular de iones Na + y iones Cl −.
Sólo hay un tipo de sólido amorfo. Sin embargo, existen varios tipos diferentes de sólidos cristalinos, dependiendo de la identidad de las unidades que componen el cristal.
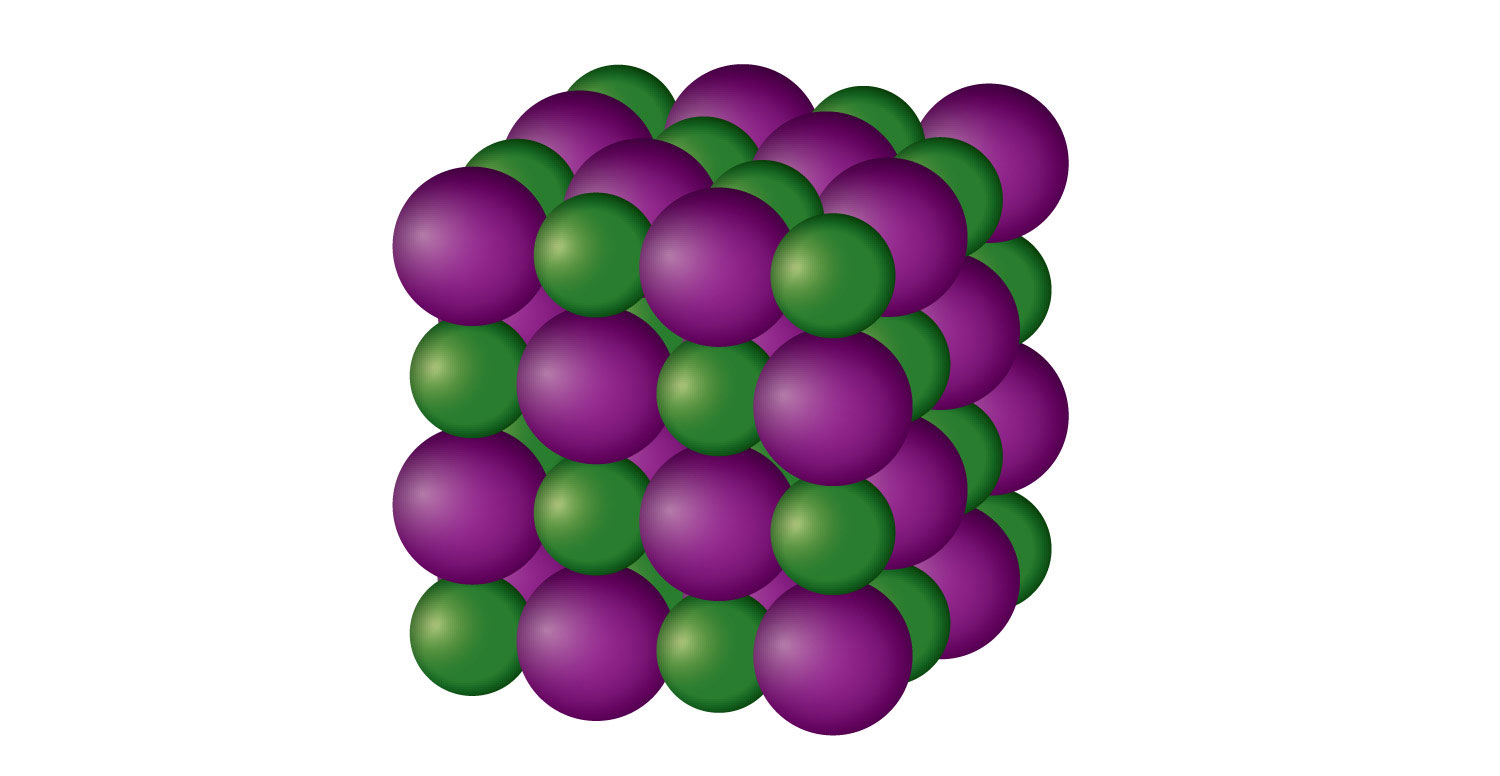
Un sólido iónico es un sólido cristalino compuesto por iones (incluso si los iones son poliatómicos). El NaCl es un ejemplo de un sólido iónico (Figura\(\PageIndex{2}\) - Un Sólido Iónico). Los iones Na + y Cl − se alternan en tres dimensiones, repitiendo un patrón que continúa a lo largo de la muestra. Los iones se mantienen unidos por la atracción de cargas opuestas, una fuerza muy fuerte. Por lo tanto, la mayoría de los sólidos iónicos tienen puntos de fusión relativamente altos; por ejemplo, el punto de fusión del NaCl es de 801°C, los sólidos iónicos suelen ser muy quebradizos. Para romperlos, es necesario romper las atracciones iónicas muy fuertes; un desplazamiento de solo alrededor de 1 × 10 −10 m moverá iones junto a iones de la misma carga, lo que resulta en repulsión. Los sólidos iónicos no conducen la electricidad en su estado sólido; sin embargo, en estado líquido y cuando se disuelven en algún solvente, conducen electricidad. Este hecho originalmente promovió la idea de que algunas sustancias existen como partículas iónicas.
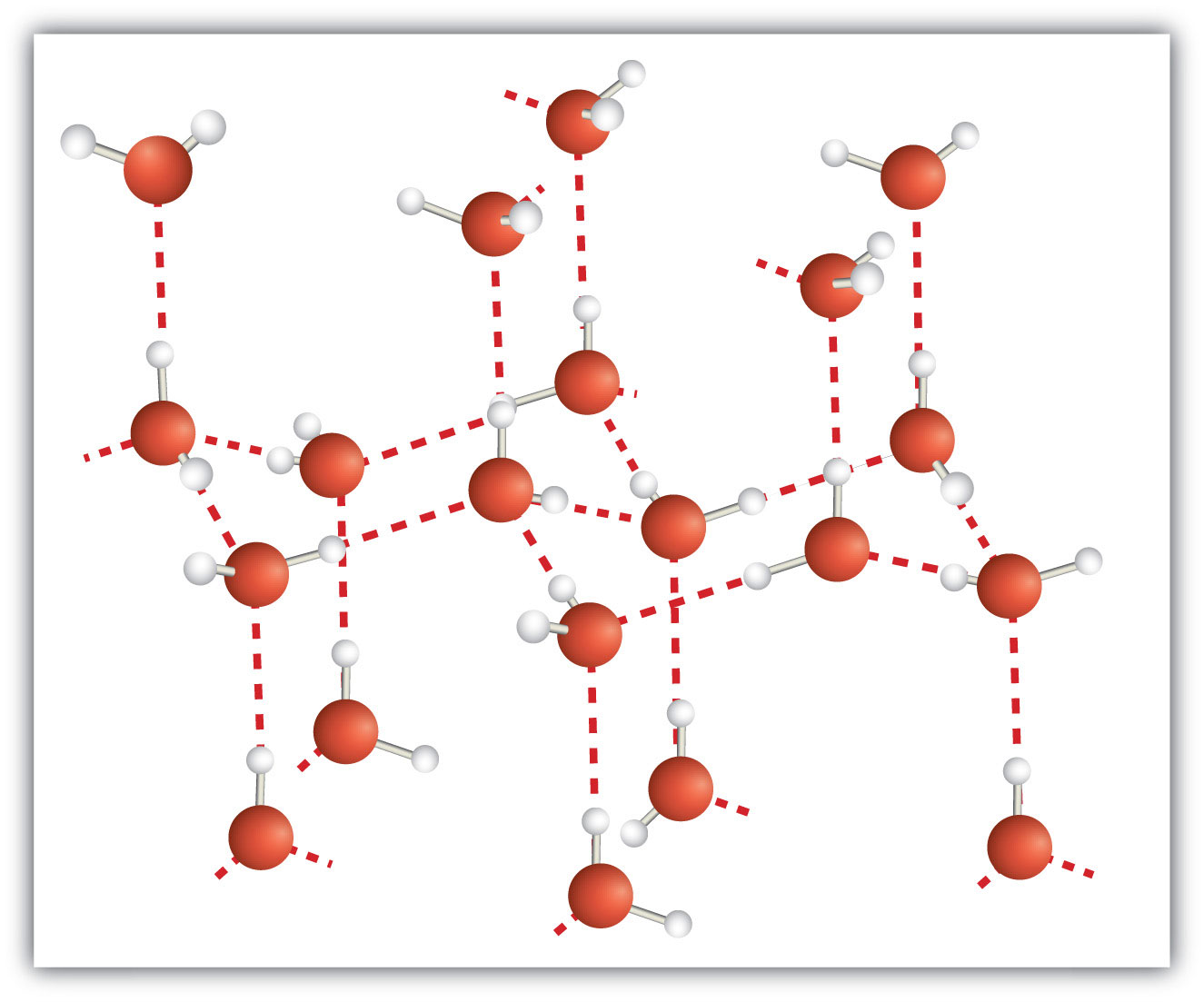
Un sólido molecular es un sólido cristalino cuyos componentes son moléculas unidas covalentemente. Muchas sustancias moleculares, especialmente cuando se solidifican cuidadosamente a partir del estado líquido, forman sólidos donde las moléculas se alinean de manera regular similar a un cristal iónico, pero están compuestas de moléculas en lugar de iones. Debido a que las fuerzas intermoleculares entre las moléculas son típicamente menos fuertes que en los sólidos iónicos, los sólidos moleculares normalmente se funden a temperaturas más bajas y son más blandos que los sólidos iónicos. El hielo es un ejemplo de un sólido molecular. En estado sólido, las moléculas se alinean en un patrón regular (Figura\(\PageIndex{3}\)). Algunas moléculas muy grandes, como las moléculas biológicas, formarán cristales solo si se solidifican con mucho cuidado a partir del estado líquido o, más a menudo, de un estado disuelto; de lo contrario, formarán sólidos amorfos.
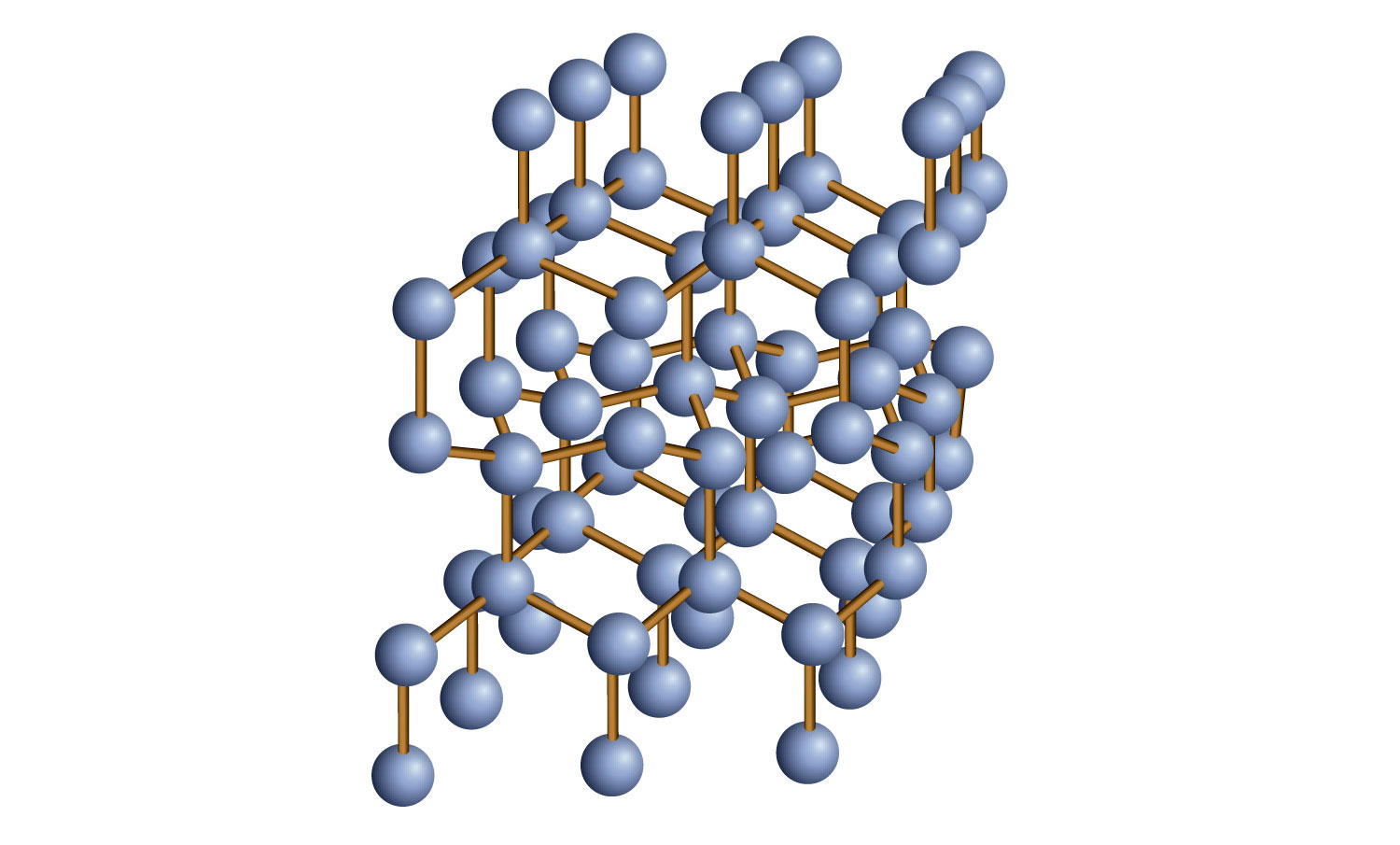
Algunos sólidos están compuestos por átomos de uno o más elementos que están unidos covalentemente entre sí de una manera aparentemente interminable. Dichos sólidos se denominan sólidos de red covalente. Cada pieza de la sustancia es esencialmente una molécula enorme, ya que el enlace covalente en el cristal se extiende por todo el cristal. Los dos sólidos de red covalente más comúnmente conocidos son el carbono en su forma de diamante y el dióxido de silicio (SiO 2). Figura\(\PageIndex{4}\) - Sólidos de Red Covalentes, muestra el enlace en un sólido de red covalente. Generalmente, los sólidos de la red covalente son malos conductores de electricidad, aunque su capacidad para conducir el calor es variable: el diamante es una de las sustancias más conductoras térmicas conocidas, mientras que el SiO 2 es aproximadamente 100 veces menos conductor térmico. La mayoría de los sólidos de la red covalente son muy duros, como lo ejemplifica el diamante, que es la sustancia más dura conocida. Los sólidos de la red covalente tienen altos puntos de fusión en virtud de su red de enlaces covalentes, todos los cuales tendrían que romperse para que se transformen en un líquido. De hecho, los sólidos de la red covalente se encuentran entre las sustancias de mayor punto de fusión conocidas: el punto de fusión del diamante es superior a 3,500°C, mientras que el punto de fusión del SiO 2 es de alrededor de 1,650°C, estas características se explican por la red de enlaces covalentes a lo largo de la muestra.
Un sólido metálico es un sólido con las propiedades características de un metal: brillante y de color plateado y un buen conductor de calor y electricidad. Un sólido metálico también puede ser martillado en láminas y tirado de cables. Un sólido metálico exhibe unión metálica, un tipo de interacción intermolecular causada por la compartición de los electrones de valencia por todos los átomos en la muestra. Es el reparto de estos electrones de valencia lo que explica la capacidad de los metales para conducir bien la electricidad y calentar bien. También es relativamente fácil que los metales pierdan estos electrones de valencia, lo que explica por qué los elementos metálicos suelen formar cationes cuando hacen compuestos.
Predecir el tipo de cristal exhibido por cada sólido.
- MgO
- Ag
- CO 2
Solución
- Una combinación de un metal y un no metal hace un compuesto iónico, por lo que el MgO existiría como cristales iónicos en estado sólido.
- La plata es un metal, por lo que existiría como un sólido metálico en estado sólido.
- El CO 2 es un compuesto molecular unido covalentemente. En estado sólido, formaría cristales moleculares. (En realidad se pueden ver los cristales en hielo seco a simple vista.)
Predecir el tipo de cristal exhibido por cada sólido.
- I 2
- Ca (NO 3) 2
RESPUESTAS
- Cristales moleculares
- cristales iónicos
Los alimentos y bebidas que comemos y bebemos tienen diferentes fases: sólido, líquido y gas. (¿Cómo ingerimos gases? Las bebidas carbonatadas tienen gas, que a veces hacen que una persona eructe.) Sin embargo, entre los sólidos que comemos, tres en particular son, o se producen a partir de, rocas. ¡Sí, rocas!
El primero es NaCl, o sal común. La sal es el único sólido que ingerimos que en realidad se extrae como una roca (de ahí el término sal de roca; realmente es una roca). La sal proporciona tanto iones Na + como iones Cl −, los cuales son necesarios para una buena salud. La sal conserva los alimentos, una función que era mucho más importante antes de los días de la moderna preparación y almacenamiento de alimentos. El hecho de que la salinidad sea uno de los principales sabores que la lengua puede detectar sugiere un fuerte vínculo evolutivo entre la ingestión de sal y la supervivencia. Existe cierta preocupación hoy en día de que haya demasiada sal en la dieta; se estima que la persona promedio consume al menos tres veces más sal diariamente que es necesaria para una correcta función corporal.
Las otras dos rocas que comemos están relacionadas: bicarbonato de sodio (NaHCO 3) y carbonato de sodio (Na 2 CO 3). Sin embargo, no extraemos estas sustancias directamente del suelo; minamos trona, cuya fórmula química es Na 3 H (CO 3) 2. Esta sustancia se disuelve en agua y se trata con gas CO 2 para hacer ya sea Na 2 CO 3 o NaHCO 3. Otro proceso, llamado el proceso Solvay, también se utiliza para hacer Na 2 CO 3. En el proceso Solvay, se añaden NH 3 y CO 2 a soluciones de NaCl para hacer NaHCO 3 y NH 4 Cl; el NaHCO 3 precipita y se calienta para producir Na 2 CO 3. De cualquier manera, obtenemos estos dos productos del suelo (es decir, rocas).
NahCo 3 también se conoce como bicarbonato de sodio, que se utiliza en muchos productos horneados. Na 2 CO 3 se utiliza en los alimentos para regular el equilibrio ácido. También se usa en lavandería (donde se llama soda de lavado) para interactuar con otros iones en el agua que tienden a reducir la eficiencia del detergente.

Resumen
- Los sólidos se pueden dividir en sólidos amorfos y sólidos cristalinos.
- Los sólidos cristalinos pueden ser iónicos, moleculares, de red covalente o metálicos.


