10.4: Propiedades de los Líquidos
- Page ID
- 74773
- Definir la presión de vapor de los líquidos.
- Explicar el origen tanto de la tensión superficial como de la acción capilar.
Hay algunas propiedades que tienen todos los líquidos, incluyendo el agua. Todos los líquidos tienen cierta porción de partículas con suficiente energía para ingresar a la fase gaseosa, y si estas partículas están en la superficie del líquido, lo hacen (Figura\(\PageIndex{1}\)). La formación de un gas a partir de un líquido a temperaturas por debajo del punto de ebullición se denomina evaporación. A estas temperaturas, el material en la fase gaseosa se llama vapor, en lugar de gas; el término gas se reserva para cuando la fase gaseosa es la fase estable.
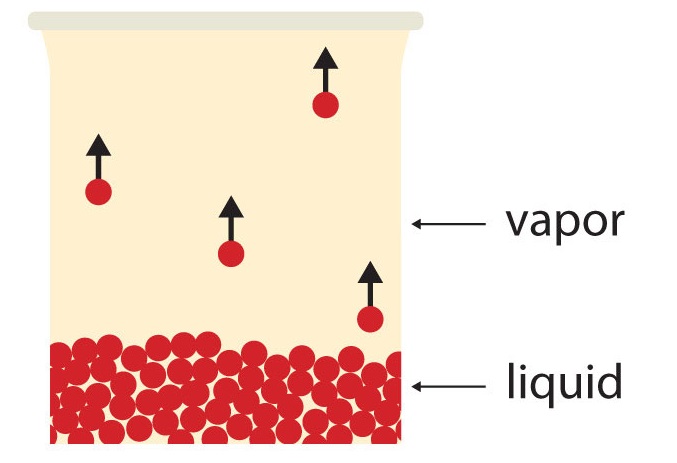
Si el volumen disponible es lo suficientemente grande, eventualmente todo el líquido se convertirá en vapor. Pero si el volumen disponible no es suficiente, eventualmente algunas de las partículas de vapor volverán a entrar en la fase líquida (Figura\(\PageIndex{2}\) Equilibrio). En algún momento, el número de partículas que ingresan a la fase de vapor será igual al número de partículas que salen de la fase de vapor, por lo que no hay ningún cambio neto en la cantidad de vapor en el sistema. Decimos que el sistema está en equilibrio. La presión parcial del vapor en equilibrio se llama presión de vapor del líquido.
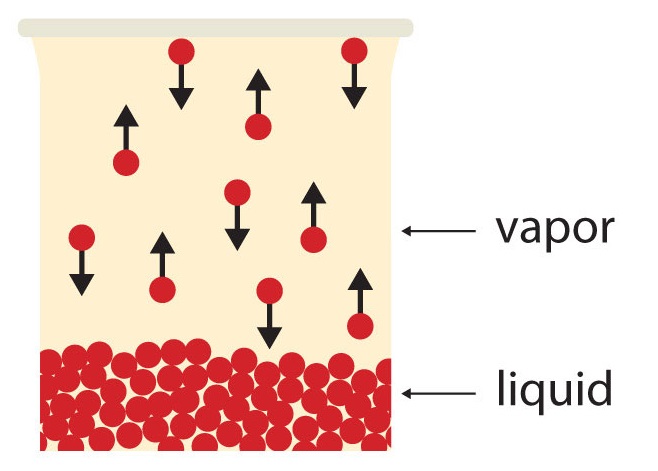
Entender que el líquido no ha dejado de evaporarse. El proceso inverso, la condensación, ocurre tan rápido como la evaporación, por lo que no hay ningún cambio neto en la cantidad de vapor en el sistema. El término equilibrio dinámico representa una situación en la que aún ocurre un proceso, pero el proceso contrario también ocurre a la misma velocidad, de manera que no hay cambio neto en el sistema.
La presión de vapor para una sustancia depende de la temperatura de la sustancia; a medida que la temperatura aumenta, también lo hace la presión de vapor. Figura\(\PageIndex{3}\) - Gráficas de Presión de Vapor versus Temperatura para Varios Líquidos, es una gráfica de presión de vapor versus temperatura para varios líquidos. Habiendo definido la presión de vapor, también podemos redefinir el punto de ebullición de un líquido: la temperatura a la que la presión de vapor de un líquido es igual a la presión ambiental circundante. La presión de vapor normal, entonces, es la temperatura a la que la presión de vapor es 760 torr, o exactamente 1 atm. Por lo tanto, los puntos de ebullición varían con la presión circundante, hecho que puede tener grandes implicaciones en la cocción de alimentos a elevaciones inferiores o superiores a lo normal. La presión atmosférica varía significativamente con la altitud.
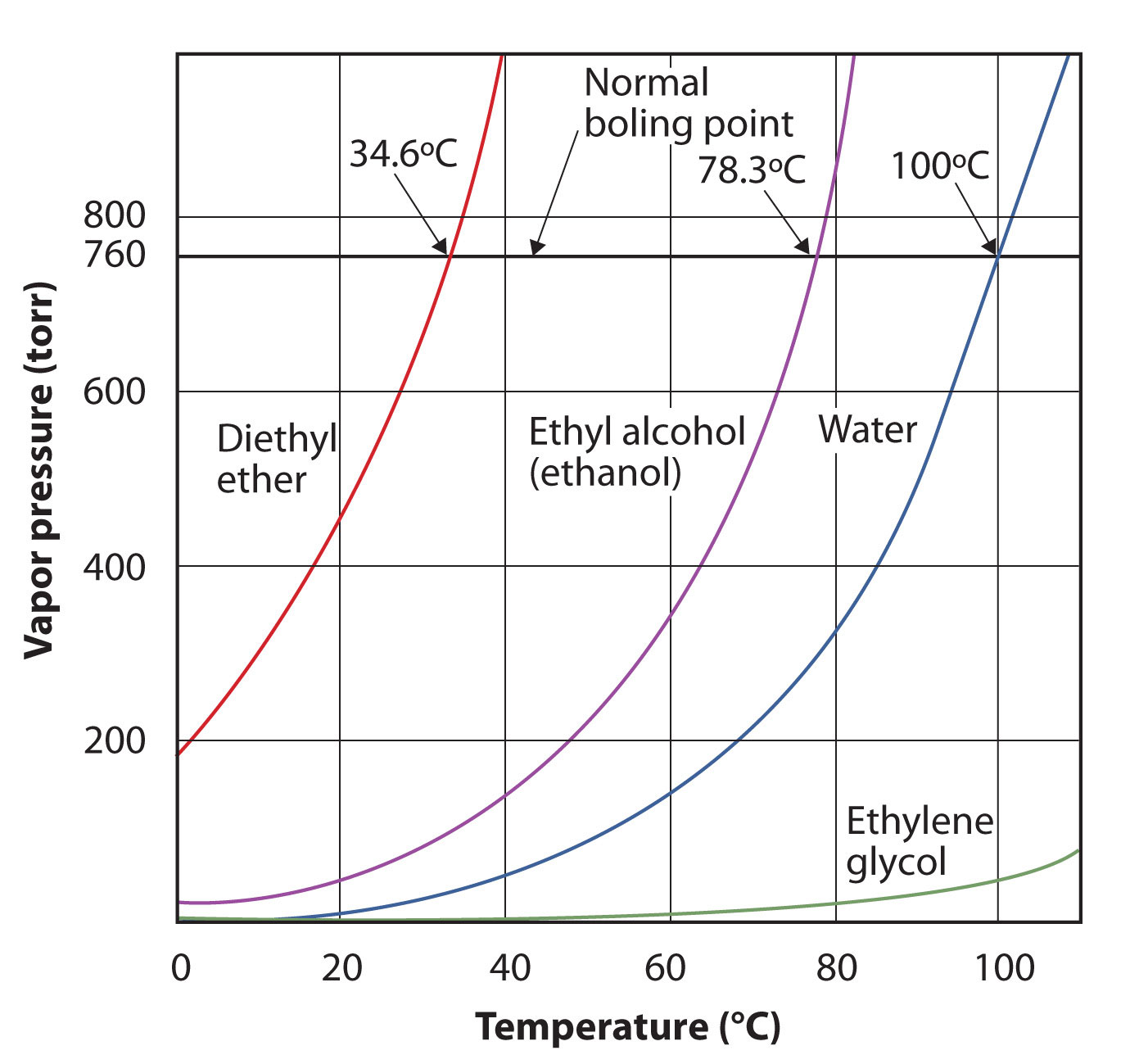
Use la Figura\(\PageIndex{3}\) para estimar el punto de ebullición del agua a 500 torr, que es la presión atmosférica aproximada en la cima del Monte Everest.
Solución
Ver la figura que lo acompaña. Quinientos torr está entre 400 y 600, por lo que extendemos una línea desde ese punto en el eje y a través de la curva para el agua y luego la bajamos al eje x para leer la temperatura asociada. Parece que el punto en la curva de presión de vapor de agua corresponde a una temperatura de aproximadamente 90°C, por lo que concluimos que el punto de ebullición del agua a 500 torr es de 90°C.
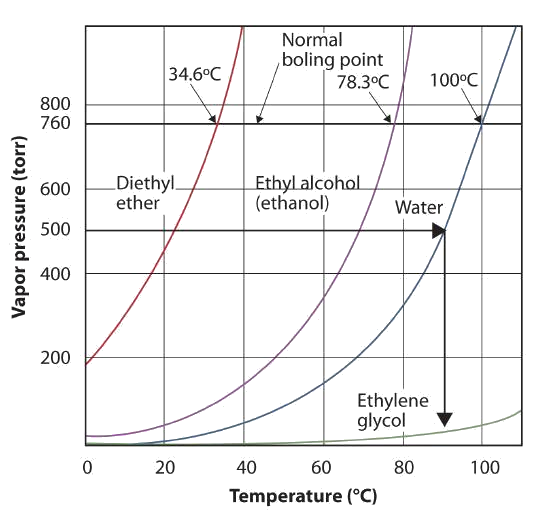
Al leer la gráfica correctamente, se puede estimar el punto de ebullición de un líquido a diferentes temperaturas.
Utilice la Figura\(\PageIndex{3}\) para estimar el punto de ebullición del etanol a 400 torr.
- Contestar
-
alrededor de 65°C
La curva de presión de vapor para el agua no es exactamente cero en el punto de fusión 0°C. Incluso el hielo tiene una presión de vapor, es por eso que se sublima con el tiempo. Sin embargo, las presiones de vapor de los sólidos son típicamente mucho más bajas que las de los líquidos. A -1 °C, la presión de vapor del hielo es de 4.2 torr. A una temperatura del congelador de 0°F (−17°C), la presión de vapor del hielo es de solo 1.0 torr; los llamados congeladores profundos pueden bajar a −23°C, donde la presión de vapor del hielo es solo 0.6 torr.
Todos los líquidos también comparten algunas otras propiedades. La tensión superficial es un efecto causado por un desequilibrio de fuerzas sobre los átomos en la superficie de un líquido, como se muestra en la Figura\(\PageIndex{4}\). La partícula azul en la mayor parte del líquido experimenta fuerzas intermoleculares de todo alrededor, como lo ilustran las flechas. Sin embargo, la partícula amarilla en la superficie no experimenta ninguna fuerza por encima de ella porque no hay partículas por encima de ella. Esto lleva a un desequilibrio de fuerzas, llamado tensión superficial.

La tensión superficial es responsable de varios comportamientos bien conocidos de los líquidos, incluyendo el agua. Los líquidos con alta tensión superficial tienden a formar bolitas cuando están presentes en pequeñas cantidades (Figura\(\PageIndex{5}\)).

La tensión superficial hace que los líquidos formen esferas en caída libre o gravedad cero. La tensión superficial también es responsable de que los pequeños insectos puedan “caminar” sobre el agua. Debido a la tensión superficial, se necesita energía para romper la superficie de un líquido, y si un objeto (como un insecto) es lo suficientemente ligero, no hay suficiente fuerza debido a la gravedad para que el objeto rompa a través de la superficie, por lo que el objeto permanece sobre el agua (Figura\(\PageIndex{6}\)). Cuidadosamente hecho, este fenómeno también se puede ilustrar con una hoja de afeitar delgada o un clip para papel.

El hecho de que pequeñas gotas de agua se acumulen en las superficies no significa que el agua, o cualquier otro líquido, no interactúe con otras sustancias. A veces la atracción puede ser muy fuerte. La adhesión es la tendencia de una sustancia a interactuar con otras sustancias debido a fuerzas intermoleculares, mientras que la cohesión es la tendencia de una sustancia a interactuar consigo misma. Si las fuerzas cohesivas dentro de un líquido son más fuertes que las fuerzas adhesivas entre un líquido y otra sustancia, entonces el líquido tiende a mantenerse para sí mismo; se va a formar bolitas. Sin embargo, si las fuerzas adhesivas entre un líquido y otra sustancia son más fuertes que las fuerzas cohesivas, entonces el líquido se extenderá sobre la otra sustancia, tratando de maximizar la interfaz entre la otra sustancia y el líquido. Se dice que el líquido moja la otra sustancia.
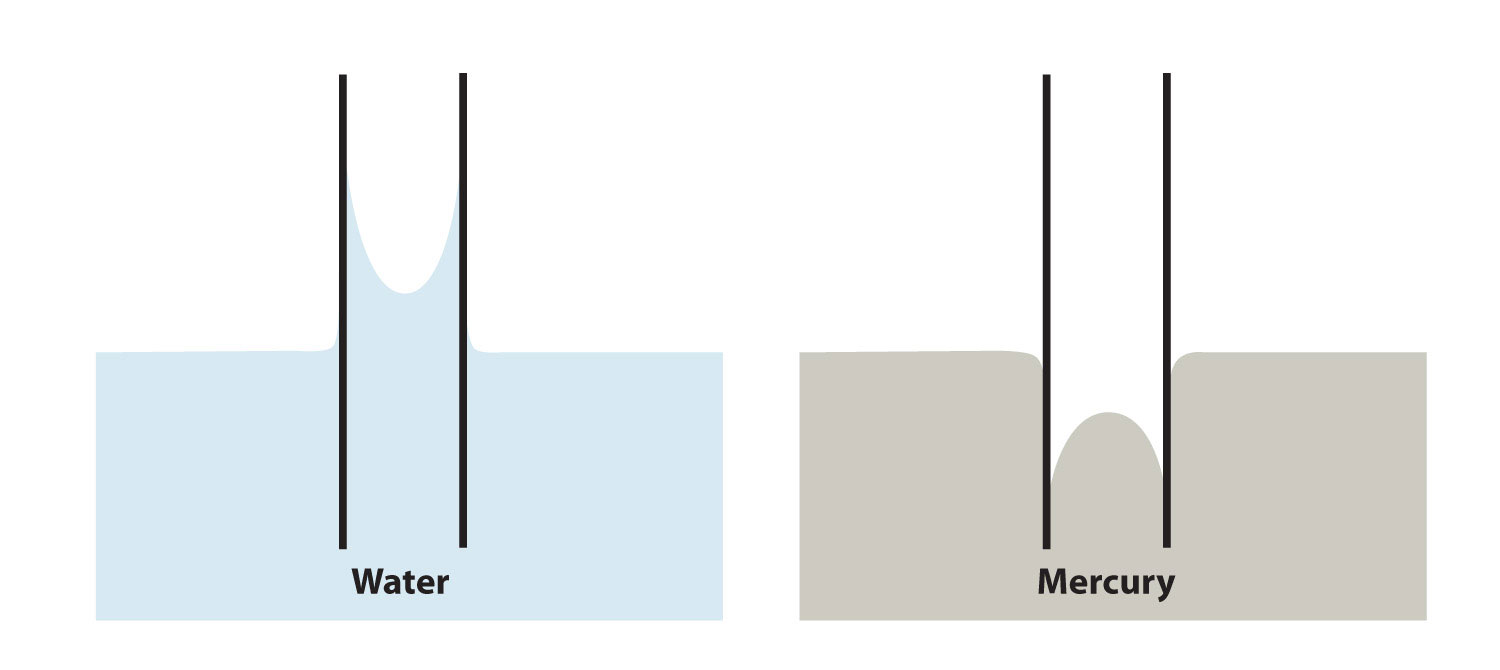
La adhesión y la cohesión también son importantes para otros fenómenos. En particular, si las fuerzas adhesivas son fuertes, entonces cuando se introduce un líquido en un tubo de pequeño diámetro de otra sustancia, el líquido se moverá hacia arriba o hacia abajo en el tubo, como si ignorara la gravedad. Debido a que los tubos diminutos se llaman capilares, a este fenómeno se le llama acción capilar. Por ejemplo, un tipo de acción capilar, el aumento capilar, se observa cuando el agua o los líquidos a base de agua se elevan en tubos de vidrio delgados (como los capilares que a veces se usan en los análisis de sangre), formando una superficie curvada hacia arriba llamada menisco. La acción capilar también es responsable del efecto “wicking” que las toallas y esponjas utilizan para secar objetos mojados; la esterilla de las fibras forma diminutos capilares que tienen buena adherencia con el agua. El algodón es un buen material para esto; el poliéster y otras telas sintéticas no muestran una acción capilar similar, razón por la cual rara vez encuentras toallas de baño de rayón. Un efecto similar se observa con los combustibles líquidos o cera fundida y sus mechas. Se cree que la acción capilar es al menos parcialmente responsable del transporte del agua desde las raíces hasta las copas de los árboles, incluso los altos.
Por otro lado, algunos líquidos tienen fuerzas cohesivas más fuertes que las fuerzas adhesivas. En este caso, en presencia de un capilar, el líquido es forzado a bajar de su superficie; este es un ejemplo de un tipo de acción capilar llamada depresión capilar. En este caso, el menisco se curva hacia abajo. El mercurio tiene fuerzas cohesivas muy fuertes; cuando se coloca un capilar en un charco de mercurio, se deprime la superficie del líquido de mercurio (Figura\(\PageIndex{7}\)).
Se anima a los propietarios de automóviles responsables a encerar sus autos regularmente. Además de hacer que el auto se vea mejor, también ayuda a proteger la superficie, especialmente si la superficie es de metal. ¿Por qué?
La respuesta tiene que ver con la cohesión y la adhesión (y, en menor medida, con el óxido). El agua es un factor importante en la oxidación del hierro, a veces utilizado ampliamente en carrocerías exteriores de automóviles. Mantener el agua alejada del metal es una forma de minimizar la oxidación. Una capa de pintura ayuda con esto. Sin embargo, la pintura sucia o rayada puede atraer agua, y las fuerzas adhesivas permitirán que el agua humedezca la superficie, maximizando su contacto con el metal y promoviendo la oxidación.

La cera está compuesta por moléculas largas de hidrocarburos que no interactúan bien con el agua. (Los hidrocarburos son compuestos con átomos de C y H; para mayor información sobre hidrocarburos, ver Capítulo 16). Es decir, una fina capa de cera no será mojada por el agua. Un automóvil recién encerado tiene bajas fuerzas adhesivas con el agua, por lo que el agua se acumula en la superficie, como consecuencia de su cohesión y tensión superficial. Esto minimiza el contacto entre el agua y el metal, minimizando así el óxido.
Resumen
- Todos los líquidos se evaporan.
- Si el volumen es limitado, la evaporación finalmente alcanza un equilibrio dinámico y se mantiene una presión de vapor constante.
- Todos los líquidos experimentan tensión superficial, un desequilibrio de fuerzas en la superficie del líquido.
- Todos los líquidos experimentan acción capilar, demostrando ya sea elevación capilar o depresión capilar en presencia de otras sustancias.


