6.2: Comparación de sustancias iónicas y moleculares
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Conocer las propiedades físicas de las sustancias iónicas y moleculares.
El estado físico y las propiedades de un compuesto en particular dependen en gran parte del tipo de unión química que muestra. Compuestos moleculares, a veces llamados
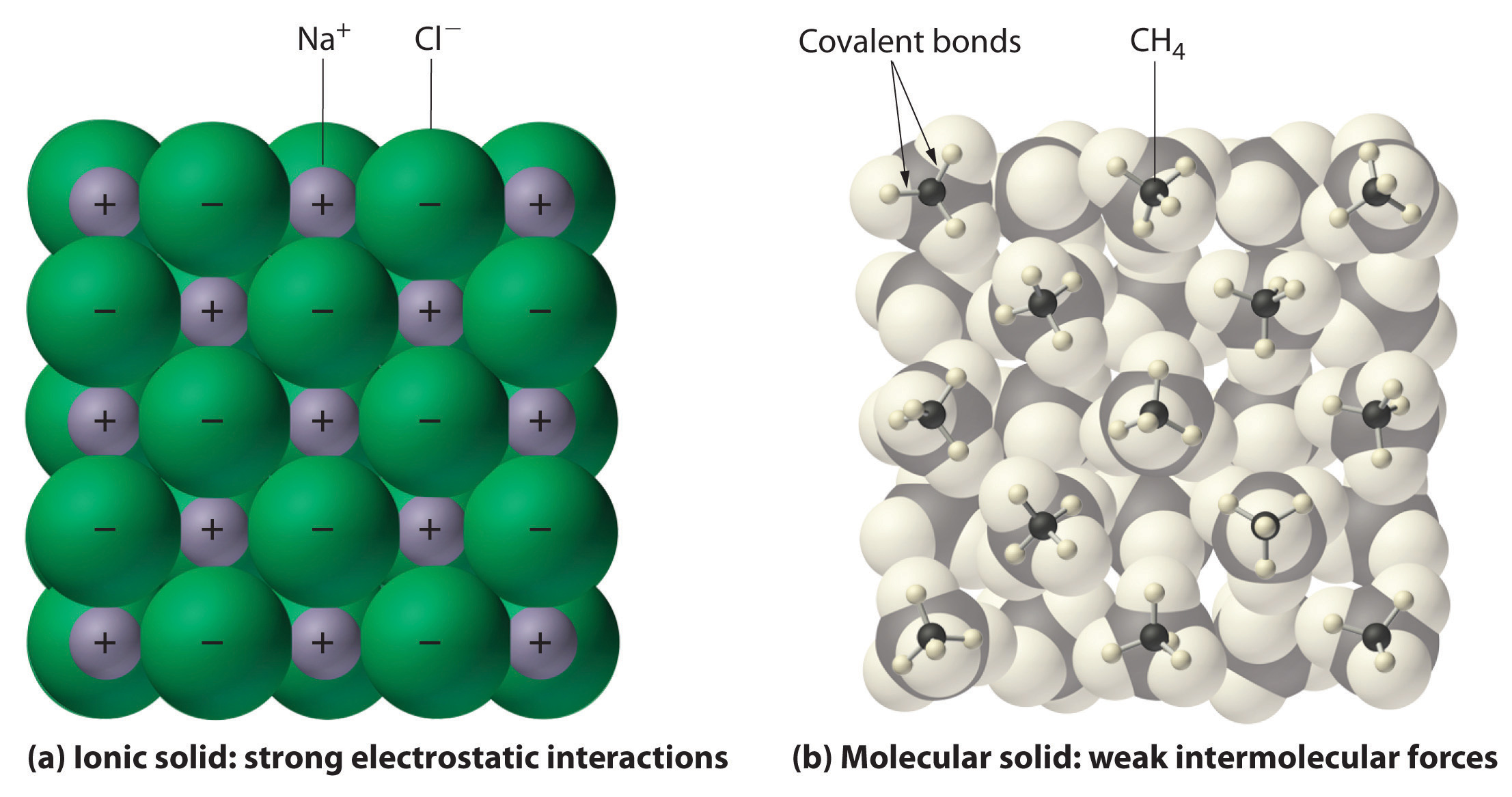
compuestos covalentes, muestran una amplia gama de propiedades físicas debido a los diferentes tipos de atracciones intermoleculares como diferentes tipos de interacciones polares. Los puntos de fusión y ebullición de los compuestos moleculares son generalmente bastante bajos en comparación con los de los compuestos iónicos. Esto se debe a que la energía requerida para interrumpir las fuerzas intermoleculares entre moléculas es mucho menor que la energía requerida para romper los enlaces iónicos en un compuesto iónico cristalino (Figura6.2.1). Los sólidos iónicos generalmente se funden a altas temperaturas y hierven a temperaturas aún más altas. Por ejemplo, el cloruro de sodio se funde a 801 °C y hierve a 1413 °C. (Como comparación, el compuesto molecular agua se funde a 0 °C y hierve a 100 °C.). La solubilidad en agua de los compuestos moleculares es variable y depende principalmente del tipo de fuerzas intermoleculares involucradas.
6.2.1Interacciones de figuras en sólidos iónicos y covalentes.
Dado que los compuestos moleculares están compuestos por moléculas neutras, su conductividad eléctrica es generalmente bastante pobre, ya sea en estado sólido o líquido. En forma sólida, un compuesto iónico no es eléctricamente conductor porque sus iones son incapaces de fluir (“electricidad” es el flujo de partículas cargadas). Cuando se funde, sin embargo, puede conducir electricidad porque sus iones son capaces de moverse libremente a través del líquido (Figura6.2.2; Video6.2.1).

Conductividad de la Sal Fundida
Video6.2.1 Mira este video para ver una mezcla de sales fundir y conducir la electricidad.
| Tabla 6.2.1Comparación de Compuestos Ionicos y Moleculares | ||
|---|---|---|
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; "> Propiedad | Compuestos Ionicos | Compuestos Moleculares |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Tipo de elementos | Metal y no metal | Solo no metales |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Unión | Iónico - transferencia de electrón (s) entre átomos | Covalente - reparto de par (s) de electrones entre átomos |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Unidad representativa | Unidad de fórmula | Molécula |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Estado físico a temperatura ambiente | Sólido | Gas, líquido o sólido |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Solubilidad en agua | Por lo general alto | Variable |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Temperaturas de fusión y ebullición | Generalmente alto | Generalmente bajo |
| \ (\ PageIndex {1}\) Comparación de compuestos iónicos y moleculares” style="vertical-align:middle; ">Conductividad eléctrica | Bueno cuando se funde o en solución | Pobre |
Un tipo de compuesto molecular se comporta de manera bastante diferente al descrito hasta ahora. Un sólido de red covalente es un compuesto en el que todos los átomos están conectados entre sí por enlaces covalentes. El diamante está compuesto completamente por átomos de carbono, cada uno unido a otros cuatro átomos de carbono en una geometría tetraédrica. La fusión de un sólido de red covalente no se logra superando las fuerzas intermoleculares relativamente débiles. Más bien, todos los enlaces covalentes deben romperse, proceso que requiere temperaturas extremadamente altas. El diamante, de hecho, no se derrite en absoluto. En cambio, se vaporiza a un gas a temperaturas superiores3500oC.
Resumen
- Las propiedades físicas de un material se ven afectadas por las fuerzas intermoleculares que mantienen unidas las moléculas.
- Los compuestos iónicos suelen formar sólidos cristalinos duros con altos puntos de fusión. Los compuestos moleculares covalentes, por el contrario, consisten en moléculas discretas unidas por fuerzas intermoleculares débiles y pueden ser gases, líquidos o sólidos a temperatura y presión ambiente.
- Los compuestos iónicos en forma fundida o en solución pueden conducir electricidad mientras que los compuestos moleculares no..
Colaboradores
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.


