6.3: Fuerzas entre Moléculas
( \newcommand{\kernel}{\mathrm{null}\,}\)
- Describir los tipos de fuerzas intermoleculares posibles entre átomos o moléculas en fases condensadas (fuerzas de dispersión, atracciones dipolo-dipolo y enlaces de hidrógeno)
- Identificar los tipos de fuerzas intermoleculares experimentadas por moléculas específicas en función de sus estructuras
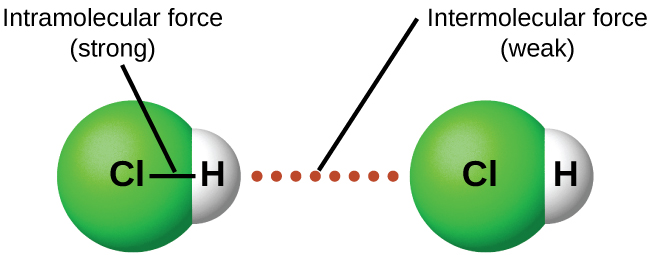
En condiciones apropiadas, las atracciones entre todas las moléculas de gas harán que formen líquidos o sólidos. Esto se debe a fuerzas intermoleculares, no a fuerzas intramoleculares. Las fuerzas intramoleculares son aquellas dentro de la molécula que mantienen unida a la molécula, por ejemplo, los enlaces entre los átomos. Las fuerzas intermoleculares son las atracciones entre las moléculas, las cuales determinan muchas de las propiedades físicas de una sustancia. La figura6.3.1 ilustra estas diferentes fuerzas moleculares. Las fuerzas de estas fuerzas de atracción varían ampliamente, aunque generalmente los IMF entre moléculas pequeñas son débiles en comparación con las fuerzas intramoleculares que unen los átomos dentro de una molécula. Por ejemplo, para superar los IMF en un mol de HCl líquido y convertirlo en HCl gaseoso se requieren sólo unos 17 kilojulios. Sin embargo, romper los enlaces covalentes entre los átomos de hidrógeno y cloro en un mol de HCl requiere aproximadamente 25 veces más energía, 430 kilojulios.
Fuerzas dipolo-dipolo
Las fuerzas dipolo-dipolo son las fuerzas atractivas que ocurren entre las moléculas polares (ver figura a continuación). Una molécula de cloruro de hidrógeno tiene un átomo de hidrógeno parcialmente positivo y un átomo de cloro parcialmente negativo. Una colección de muchas moléculas de cloruro de hidrógeno se alinearán para que las regiones con carga de oposición de las moléculas vecinas estén cerca unas de otras.
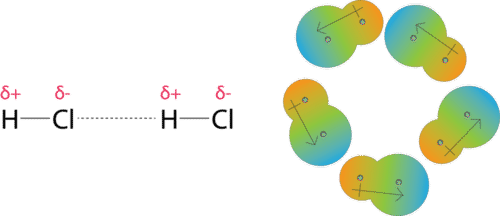
La fuerza de las interacciones intermoleculares aumenta a medida que aumenta el momento dipolar de las moléculas, como se muestra en la Tabla6.3.1.
| Compuesto | Masa molar (g/mol) | Momento dipolo (D) | Punto de ebullición (K) |
|---|---|---|---|
| C 3 H 6 (ciclopropano) | 42 | 0 | 240 |
| CH 3 OCH 3 (éter dimetílico) | 46 | 1.30 | 248 |
| CH 3 CN (acetonitrilo) | 41 | 3.9 | 355 |
La energía atractiva entre dos iones es proporcional a 1/r, mientras que la energía atractiva entre dos dipolos es proporcional a 1/r6.
Predecir cuál tendrá el punto de ebullición más alto: N 2 o CO. Explica tu razonamiento.
Solución
CO y N 2 son moléculas diatómicas con masas de aproximadamente 28 amu, por lo que experimentan fuerzas de dispersión similares en Londres. Debido a que el CO es una molécula polar, experimenta atracciones dipolo-dipolo. Debido a que N 2 es no polar, sus moléculas no pueden exhibir atracciones dipolo-dipolo. Las atracciones dipolo-dipolo entre las moléculas de CO son comparablemente más fuertes que las fuerzas de dispersión entre las moléculas de N 2 no polares, por lo que se espera que el CO tenga el punto de ebullición más alto.
Un método común para preparar oxígeno es la descomposición
Predecir cuál tendrá el punto de ebullición más alto:ICl oBr2. Explica tu razonamiento.
- Contestar
-
iCL. ICl y Br 2 tienen masas similares (~160 amu) y por lo tanto experimentan fuerzas de dispersión similares en Londres. ICl es polar y por lo tanto también exhibe atracciones dipolo-dipolo; Br 2 es no polar y no lo hace. Las atracciones dipolo-dipolo relativamente más fuertes requieren más energía para superar, por lo que iCL tendrá el punto de ebullición más alto
Fuerzas de Dispersión
Las fuerzas de dispersión son las más débiles de todas las fuerzas intermoleculares. A menudo se les llama fuerzas londinenses después de Fritz London (1900 - 1954), quien propuso por primera vez su existencia en 1930. Las fuerzas de dispersión de Londres son fuerzas intermoleculares que ocurren entre todos los átomos y moléculas debido al movimiento aleatorio de los electrones.
Por ejemplo, la nube de electrones de un átomo de helio contiene dos electrones, y, cuando se promedian con el tiempo, estos electrones se distribuirán uniformemente alrededor del núcleo. Sin embargo, en cualquier momento dado, la distribución de electrones puede ser desigual, dando como resultado un dipolo instantáneo. Este dipolo débil y temporal puede influir posteriormente en los átomos de helio vecinos a través de la atracción electrostática y la repulsión. A continuación se ilustra la formación de un dipolo inducido.

Las fuerzas de dispersión que se desarrollan entre los átomos en diferentes moléculas pueden atraer a las dos moléculas entre sí. Las fuerzas son relativamente débiles, sin embargo, y se vuelven significativas solo cuando las moléculas están muy cerca. Los átomos y moléculas más grandes y más pesados exhiben fuerzas de dispersión más fuertes que los átomos y moléculas más pequeños y más ligeros. F 2 y Cl 2 son gases a temperatura ambiente (reflejando fuerzas de atracción más débiles); Br 2 es un líquido e I 2 es un sólido (reflejando fuerzas de atracción más fuertes). Las tendencias en los puntos de fusión y ebullición observados para los halógenos demuestran claramente este efecto, como se ve en la Tabla6.3.1.
| Halógeno | Masa molar | Radio Atómico | Punto de fusión | Punto de ebullición |
|---|---|---|---|---|
| flúor, F 2 | 38 g/mol | 72 pm | 53 K | 85 K |
| cloro, Cl 2 | 71 g/mol | 99 pm | 172 K | 238 K |
| bromo, Br 2 | 160 g/mol | 114pm | 266 K | 332 K |
| yodo, I 2 | 254 g/mol | 133pm | 387 K | 457 K |
| astatino, At 2 | 420 g/mol | 150pm | 575 K | 610 K |
El aumento en los puntos de fusión y ebullición con el aumento del tamaño atómico/molecular puede racionalizarse considerando cómo la fuerza de las fuerzas de dispersión se ve afectada por la estructura electrónica de los átomos o moléculas en la sustancia. En un átomo mayor, los electrones de valencia están, en promedio, más alejados de los núcleos que en un átomo más pequeño. Así, se sujetan con menos fuerza y pueden formar más fácilmente los dipolos temporales que producen la atracción. La medida de lo fácil o difícil que es para otra carga electrostática (por ejemplo, un ion cercano o molécula polar) distorsionar la distribución de carga de una molécula (su nube de electrones) se conoce como polarizabilidad. Se dice que una molécula que tiene una nube de carga que se distorsiona fácilmente es muy polarizable y tendrá grandes fuerzas de dispersión; una con una nube de carga que es difícil de distorsionar no es muy polarizable y tendrá pequeñas fuerzas de dispersión.
Para sustancias similares, las fuerzas de dispersión de Londres se vuelven más fuertes al aumentar el tamaño atómico o molecular.
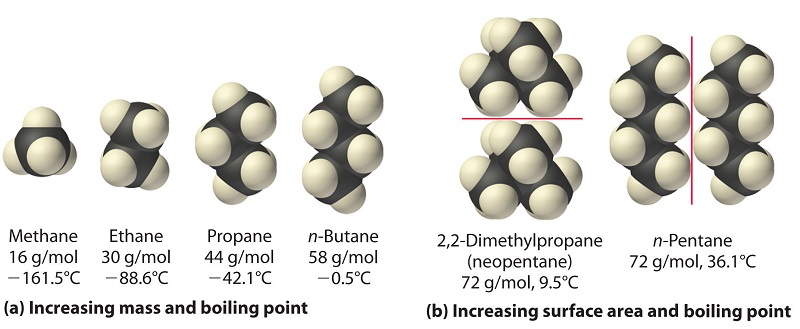
Las fortalezas de las fuerzas de dispersión de Londres también dependen significativamente de la forma molecular porque la forma determina cuánto de una molécula puede interactuar con sus moléculas vecinas en un momento dado. Por ejemplo, la parte (b) de la Figura6.3.4 muestra 2,2-dimetilpropano (neopentano) y n-pentano, los cuales tienen la fórmula empírica C 5 H 12. El neopentano es casi esférico, con una pequeña superficie para interacciones intermoleculares, mientras que el n-pentano tiene una conformación extendida que le permite entrar en contacto cercano con otras moléculas de n-pentano. Como resultado, el punto de ebullición del neopentano (9.5°C) es más de 25°C menor que el punto de ebullición del n-pentano (36.1°C).
Todas las moléculas, sean polares o no polares, son atraídas entre sí por las fuerzas de dispersión de Londres además de cualquier otra fuerza atractiva que pueda estar presente.
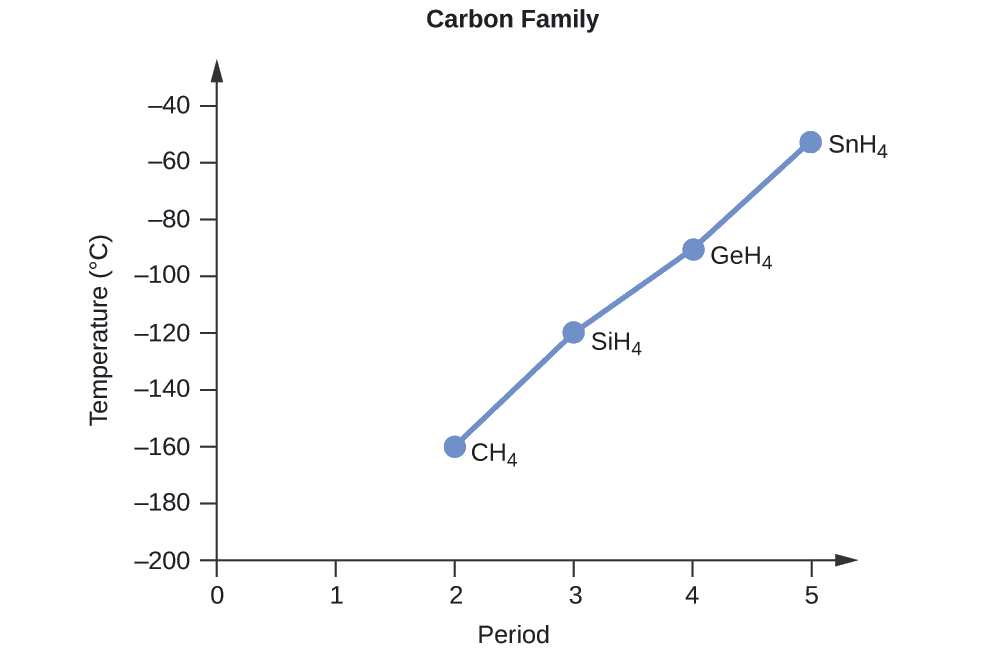
Ordene los siguientes compuestos de un elemento del grupo 14 e hidrógeno de menor a mayor punto de ebullición: CH 4, SiH 4, GeH 4 y SnH 4. Explica tu razonamiento.
Dado: compuestos
Preguntado por: orden de aumentar los puntos de ebullición
Estrategia:
Determinar las fuerzas intermoleculares en el compuesto. Además, compare las masas molares y el área superficial de compuestos con tipos similares de fuerza intermolecular. La sustancia con las fuerzas más débiles y las masas molares más bajas y menor área superficial tienen el punto de ebullición más bajo.
Solución
Aplicando las habilidades adquiridas en el capítulo sobre unión química y geometría molecular, se predice que todos estos compuestos son no polares, por lo que pueden experimentar solo fuerzas de dispersión: cuanto más pequeña sea la molécula, menos polarizable y más débiles sean las fuerzas de dispersión; cuanto mayor sea la molécula, mayor será fuerzas de dispersión. Las masas molares de CH 4, SiH 4, GeH 4 y SnH 4 son aproximadamente 16 g/mol, 32 g/mol, 77 g/mol y 123 g/mol, respectivamente. Por lo tanto, se espera que CH 4 tenga el punto de ebullición más bajo y SnH 4 el punto de ebullición más alto. Se espera que el orden del punto de ebullición más bajo al más alto sea
CH 4 < SiH 4 < GeH 4 < SnH 4
Una gráfica de los puntos de ebullición reales de estos compuestos versus el periodo de los elementos del grupo 14 muestra que esta predicción es correcta:
Ordene los siguientes hidrocarburos de menor a mayor punto de ebullición: C 2 H 6, C 3 H 8 y C 4 H 10.
- Contestar
-
Todos estos compuestos son no polares y solo tienen fuerzas de dispersión de Londres: cuanto mayor es la molécula, mayores son las fuerzas de dispersión y mayor es el punto de ebullición. El orden del punto de ebullición más bajo al más alto es por lo tanto
C 2 H 6 < C 3 H 8 < C 4 H 10.
Enlaces de hidrógeno
La fuerza de atracción entre las moléculas de agua es un tipo inusualmente fuerte de interacción dipolo-dipolo. El agua contiene átomos de hidrógeno que están unidos a un átomo de oxígeno altamente electronegativo, lo que genera enlaces muy polares. El átomo de hidrógeno parcialmente positivo de una molécula es entonces atraído por el átomo de oxígeno de una molécula de agua cercana (ver figura abajo).
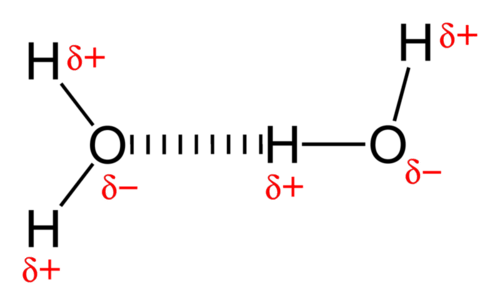
Un enlace de hidrógeno es una fuerza de atracción intermolecular en la que un átomo de hidrógeno, que está unido covalentemente a un átomo pequeño y altamente electronegativo, es atraído por un par solitario de electrones en un átomo en una molécula vecina. Los enlaces de hidrógeno son muy fuertes en comparación con otras interacciones dipolo-dipolo, pero aún mucho más débiles que un enlace covalente. Un enlace de hidrógeno típico es aproximadamente5% tan fuerte como un enlace covalente.
Los enlaces de hidrógeno ocurren solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno. Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica del enlace covalente con hidrógeno, dejando alH átomo muy deficiente en electrones. Debido a que el átomo de hidrógeno no tiene electrones que no sean los del enlace covalente, su núcleo cargado positivamente está casi completamente expuesto, permitiendo fuertes atractivos a otros pares de electrones solitarios cercanos.
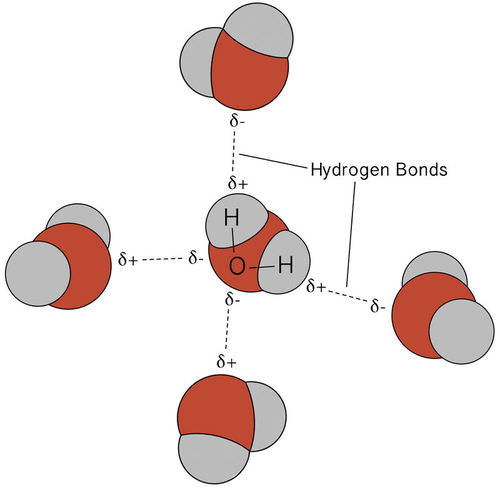
El enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Sin embargo, debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido. La siguiente figura muestra cómo su forma doblada y la presencia de dos átomos de hidrógeno por molécula permiten que cada molécula de agua se enlace de hidrógeno con varias otras moléculas.
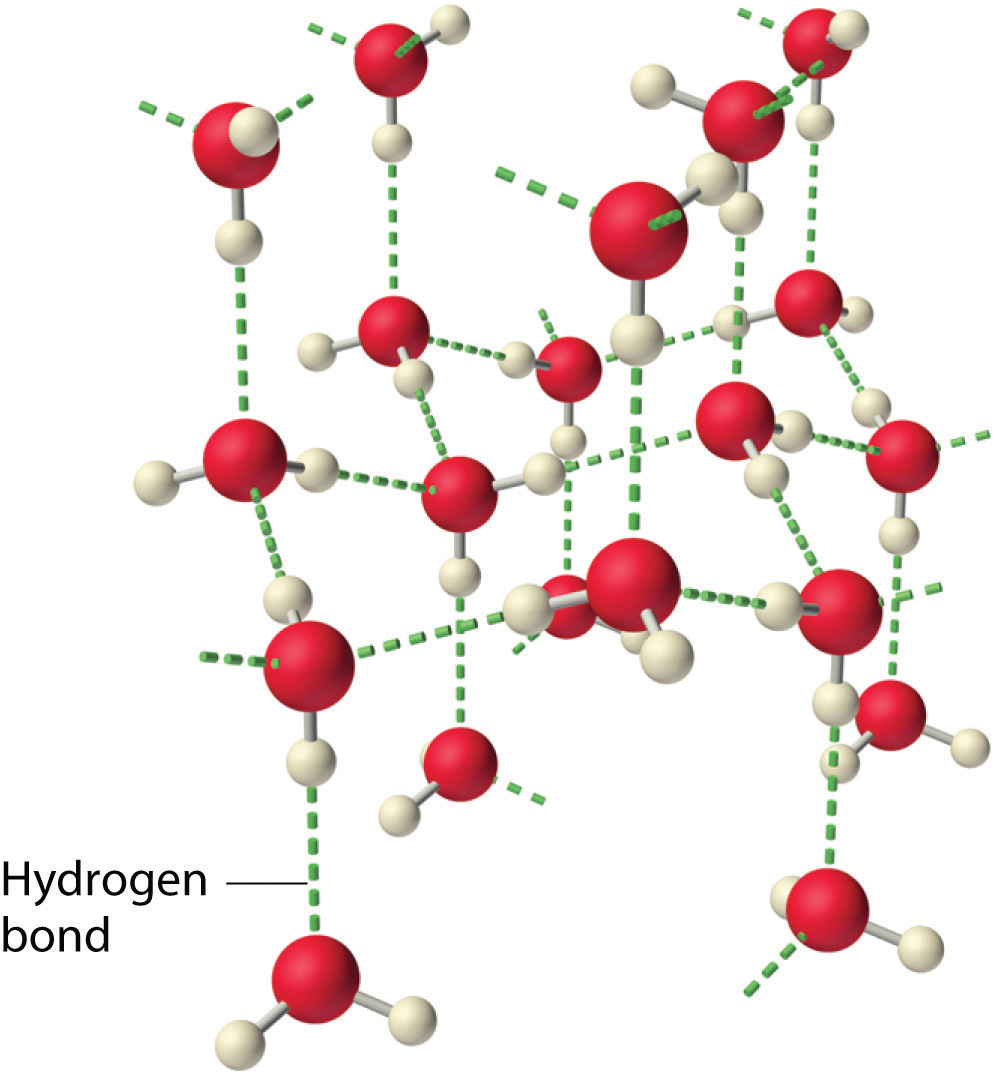
En estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando se enfría el agua, las moléculas comienzan a disminuir la velocidad. Eventualmente, cuando el agua se congela en hielo, los enlaces de hidrógeno se vuelven más rígidos y forman una red bien definida (Figura6.3.7). La forma doblada de las moléculas conduce a huecos en la red de enlaces de hidrógeno del hielo. El hielo tiene la propiedad muy inusual de que su estado sólido es menos denso que su estado líquido. Como resultado, el hielo flota en agua líquida. Prácticamente todas las demás sustancias son más densas en estado sólido que en estado líquido. Los enlaces de hidrógeno también juegan un papel biológico muy importante en las estructuras físicas de proteínas y ácidos nucleicos.
La formación de enlaces de hidrógeno requiere tanto un donante de enlace de hidrógeno como un aceptor de enlace de hidrógeno.
Debido a que el hielo es menos denso que el agua líquida, los ríos, lagos y océanos se congelan de arriba hacia abajo. De hecho, el hielo forma una capa superficial protectora que aísla el resto del agua, permitiendo que los peces y otros organismos sobrevivan en los niveles inferiores de un lago o mar congelado. Si el hielo fuera más denso que el líquido, el hielo formado en la superficie en clima frío se hundiría tan rápido como se formó. Los cuerpos de agua se congelarían de abajo hacia arriba, lo que sería letal para la mayoría de las criaturas acuáticas. La expansión del agua al congelarse también explica por qué los motores de automóviles o embarcaciones deben estar protegidos por “anticongelante” y por qué las tuberías desprotegidas en las casas se rompen si se les permite congelarse.
Fuerza de las Fuerzas Intermoleculares
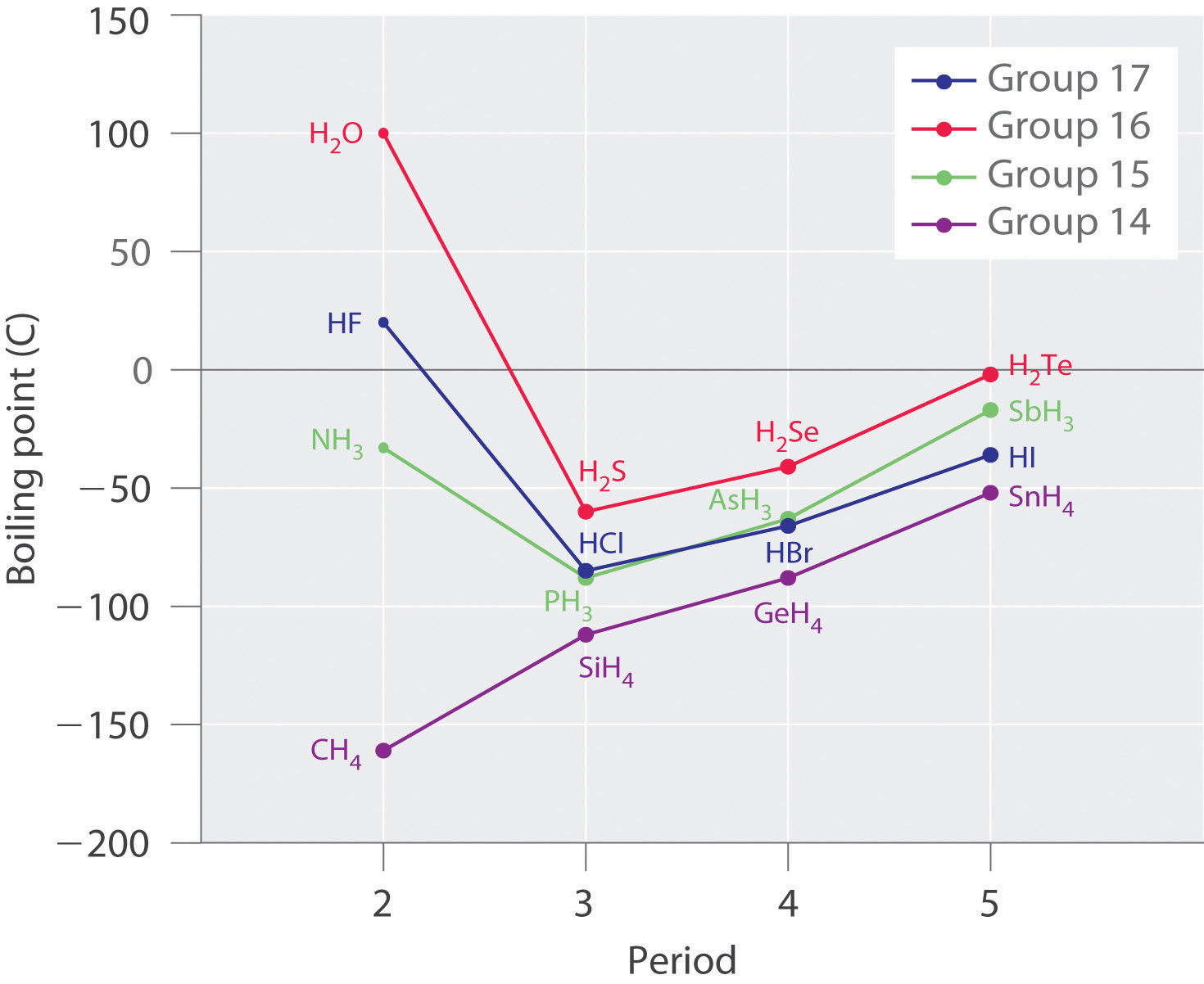
Las moléculas con átomos de hidrógeno unidos a átomos electronegativos como O, N y F tienden a exhibir interacciones intermoleculares inusualmente fuertes debido a enlaces de hidrógeno como se ilustra para los hidruros covalentes de elementos de los grupos 14—17 en la Figura6.3.8. Estos dan como resultado puntos de ebullición mucho más altos que los observados para las sustancias en las que dominan las fuerzas dipolo-dipolo o las fuerzas de dispersión de Londres. Todas las moléculas polares (con fuerzas predominantemente dipolo-dipolo) en el grupo 16 (H 2 S a H 2 Te) tienen puntos de ebullición más bajos que H 2 O (con enlaces de hidrógeno). El metano y sus congéneres más pesados en el grupo 14 forman una serie cuyos puntos de ebullición aumentan suavemente al aumentar la masa molar. Esta es la tendencia esperada en las moléculas no polares, para las cuales las fuerzas de dispersión de Londres son las fuerzas intermoleculares exclusivas. En contraste, los hidruros de los miembros más ligeros de los grupos 15—17 tienen puntos de ebullición que son más de 100°C mayores de lo previsto en base a sus masas molares. El efecto es más dramático para el agua: si extendemos la línea recta que conecta los puntos para H 2 Te y H 2 Se a la línea para el periodo 2, ¡obtenemos un punto de ebullición estimado de −130°C para el agua! Imagínese las implicaciones para la vida en la Tierra si el agua hierve a -130°C en lugar de 100°C.
Considerando CH 3 OH, C 2 H 6, Xe, y (CH 3) 3 N, ¿cuáles pueden formar enlaces de hidrógeno consigo mismos? Dibujar las estructuras unidas por hidrógeno.
Dado: compuestos
Preguntado por: formación de enlaces de hidrógeno y estructura
Estrategia:
- Identificar los compuestos con un átomo de hidrógeno unido a O, N o F. Estos probablemente puedan actuar como donantes de enlaces de hidrógeno.
- De los compuestos que pueden actuar como donantes de enlaces de hidrógeno, identificar aquellos que también contienen pares solitarios de electrones, lo que les permite ser aceptores de enlaces de hidrógeno. Si una sustancia es tanto un donador de hidrógeno como un aceptor de enlaces de hidrógeno, dibuje una estructura que muestre el enlace de hidrógeno.
Solución:
A De las especies enumeradas, el xenón (Xe), el etano (C 2 H 6) y la trimetilamina [(CH 3) 3 N] no contienen un átomo de hidrógeno unido a O, N o F; de ahí que no puedan actuar como donantes de enlaces de hidrógeno.
B El único compuesto que puede actuar como donador de enlaces de hidrógeno, metanol (CH 3 OH), contiene tanto un átomo de hidrógeno unido a O (convirtiéndolo en un donador de enlaces de hidrógeno) como dos pares solitarios de electrones en O (convirtiéndolo en un aceptor de enlaces de hidrógeno); el metanol puede así formar enlaces de hidrógeno actuando como un donador de enlaces de hidrógeno o un aceptor de enlaces de hidrógeno. La estructura unida a hidrógeno del metanol es la siguiente:
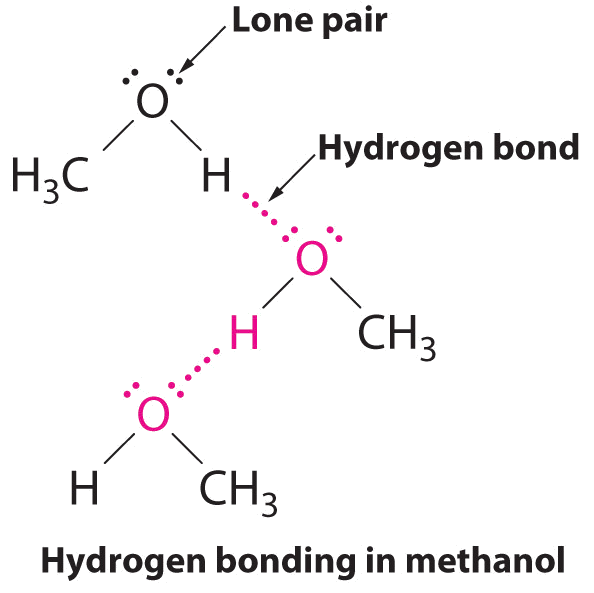
Considerando CH 3 CO 2 H, (CH 3) 3 N, NH 3 y CH 3 F, ¿cuáles pueden formar enlaces de hidrógeno consigo mismos? Dibujar las estructuras unidas por hidrógeno.
- Contestar
-
CH 3 CO 2 H y NH 3;
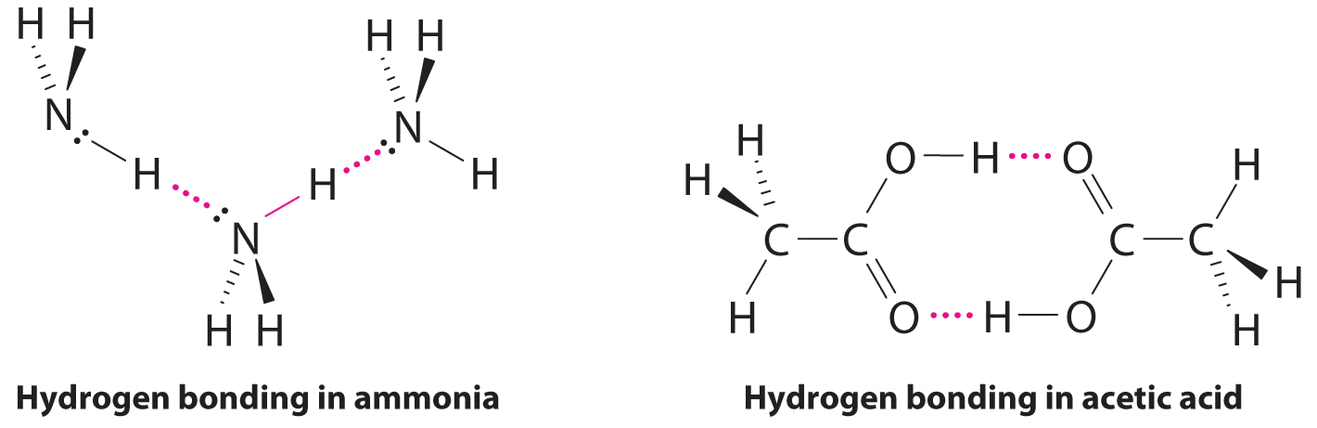
Aunque los enlaces de hidrógeno son significativamente más débiles que los enlaces covalentes, con energías de disociación típicas de solo 15—25 kJ/mol, tienen una influencia significativa en las propiedades físicas de un compuesto. Compuestos como el HF pueden formar solo dos enlaces de hidrógeno a la vez como pueden, en promedio, el NH 3 líquido puro. En consecuencia, aunque sus masas moleculares son similares a las del agua, sus puntos de ebullición son significativamente más bajos que el punto de ebullición del agua, que forma cuatro enlaces de hidrógeno a la vez.
Organizar C 60 (buckminsterfullereno, que tiene una estructura de jaula), NaCl, He, Ar y N 2 O en orden de aumentar los puntos de ebullición.
Dado: compuestos
Preguntado por: orden de aumentar los puntos de ebullición
Estrategia:
Identificar las fuerzas intermoleculares en cada compuesto y luego organizar los compuestos de acuerdo con la fuerza de esas fuerzas. La sustancia con las fuerzas más débiles tendrá el punto de ebullición más bajo.
Solución:
Las interacciones electrostáticas son más fuertes para un compuesto iónico, por lo que esperamos que el NaCl tenga el punto de ebullición más alto. Para predecir los puntos de ebullición relativos de los otros compuestos, debemos considerar su polaridad (para las interacciones dipolo-dipolo), su capacidad para formar enlaces de hidrógeno y su masa molar (para las fuerzas de dispersión de Londres). El helio es no polar y con mucho el más ligero, por lo que debe tener el punto de ebullición más bajo. Argón y N 2 O tienen masas molares muy similares (40 y 44 g/mol, respectivamente), pero N 2 O es polar mientras que Ar no lo es. En consecuencia, N 2 O debe tener un punto de ebullición más alto. Una molécula C 60 es no polar, pero su masa molar es de 720 g/mol, mucho mayor que la de Ar o N 2 O. Debido a que los puntos de ebullición de las sustancias no polares aumentan rápidamente con la masa molecular, C 60 debe hervir a una temperatura más alta que las otras sustancias no iónicas. El orden previsto es así como sigue, con puntos de ebullición reales entre paréntesis:
He (−269°C) < Ar (−185.7°C) < N 2 O (−88.5°C) < C 60 (>280°C) < NaCl (1465°C).
Disponer 2,4-dimetilheptano, Ne, CS 2, Cl 2 y KBr en orden de puntos de ebullición decrecientes.
- Contestar
-
KBr (1435°C) > 2,4-dimetilheptano (132.9°C) > CS 2 (46.6°C) > Cl 2 (−34.6°C) > Ne (−246°C)
Identificar la fuerza intermolecular más significativa en cada sustancia.
- C 3 H 8
- CH 3 OH
- H 2 S
Solución
a. Aunque los enlaces C—H son polares, solo son mínimamente polares. La fuerza intermolecular más significativa para esta sustancia serían las fuerzas de dispersión.
b. Esta molécula tiene un átomo de H unido a un átomo de O, por lo que experimentará enlaces de hidrógeno.
c. Aunque esta molécula no experimenta enlaces de hidrógeno, el diagrama de puntos electrónicos de Lewis y VSEPR indican que está doblada, por lo que tiene un dipolo permanente. La fuerza más significativa en esta sustancia es la interacción dipolo-dipolo.
Identificar la fuerza intermolecular más significativa en cada sustancia.
- HF
- HCl
- Contestar a
-
enlaces de hidrógeno
- Respuesta b
-
interacciones dipolo-dipolo
Resumen
- Las moléculas en los líquidos se mantienen a otras moléculas por interacciones intermoleculares, que son más débiles que las interacciones intramoleculares que mantienen los átomos juntos dentro de moléculas e iones poliatómicos.
- Las interacciones dipolo-dipolo surgen de las interacciones electrostáticas de los extremos positivo y negativo de moléculas con momentos dipolares permanentes.
- Las fuerzas de dispersión de Londres se deben a la formación de momentos dipolares instantáneos en moléculas polares y no polares como resultado de fluctuaciones de corta duración de la distribución de carga electrónica, que a su vez provocan la formación temporal de un dipolo inducido en moléculas.
- Los enlaces de hidrógeno son especialmente fuertes interacciones dipolo-dipolo entre moléculas que tienen enlaces de hidrógeno a un átomo altamente electronegativo, como O, N o F. El átomo de H parcialmente cargado positivamente resultante en una molécula (el donador de enlace de hidrógeno) puede interactuar fuertemente con un par solitario de electrones de un átomo de O, N o F parcialmente cargado negativamente en moléculas adyacentes (el aceptor de enlace de hidrógeno).
Colaboradores y Atribuciones
- TextMap: Chemistry the Central Science (Brown et al.
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- Libretext: Chemistry for Allied Health (Soult)

