6.4: Fuerzas en Soluciones
- Page ID
- 72351
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Aprende algo de terminología que involucra soluciones.
- Explicar el significado de la afirmación “como se disuelve como”.
- Explique por qué ciertas sustancias se disuelven en otras sustancias.
Una solución es otro nombre para una mezcla homogénea. Una mezcla como material compuesto por dos o más sustancias. En una solución, la combinación es tan íntima que el

diferentes sustancias no pueden diferenciarse a la vista, ni siquiera con un microscopio. Compara, por ejemplo, una mezcla de sal y pimienta y otra mezcla consistente en sal y agua. En la primera mezcla, podemos ver fácilmente granos individuales de sal y las motas de pimienta. Una mezcla de sal y pimienta no es una solución. No obstante, en la segunda mezcla, por muy cuidadosamente que miremos, no podemos ver dos sustancias distintas. La sal disuelta en agua es una solución.
El componente principal de una solución, llamado disolvente, es típicamente la misma fase que la solución misma. Cada componente menor de una solución (y puede haber más de uno) se llama soluto. En la mayoría de las soluciones que describiremos en este libro de texto, no habrá ambigüedad sobre si un componente es el solvente o el soluto.) Por ejemplo, en una solución de sal en agua, el soluto es sal, y el disolvente es agua Figura\(\PageIndex{1}\).
Las soluciones vienen en todas las fases, y el disolvente y el soluto no tienen que estar en la misma fase para formar una solución (como sal y agua). Por ejemplo, el aire es una solución gaseosa de aproximadamente 80% de nitrógeno y aproximadamente 20% de oxígeno, con algunos otros gases presentes en cantidades mucho menores. Una aleación es una solución sólida que consiste en un metal (como el hierro) con algunos otros metales o no metales disueltos en él. El acero, una aleación de hierro y carbono y pequeñas cantidades de otros metales, es un ejemplo de una solución sólida. Tabla\(\PageIndex{1}\) enumera algunos tipos comunes de soluciones, con ejemplos de cada una.
| Fase Solvente | Fase de soluto | Ejemplo |
|---|---|---|
| gas | gas | aire |
| líquido | gas | bebidas carbonatadas |
| líquido | líquido | etanol (C 2 H 5 OH) en H 2 O (bebidas alcohólicas) |
| líquido | sólido | agua salada |
| sólido | gas | H 2 gas absorbido por el metal Pd |
| sólido | líquido | Hg (l) en empastes dentales |
| sólido | sólido | aleaciones de acero |
Se elabora una solución disolviendo 1.00 g de sacarosa (\(\ce{C12H22O11}\)) en 100.0 g de agua líquida. Identificar el solvente y soluto en la solución resultante.
Solución
Ya sea en masa o por moles, el componente menor obvio es la sacarosa, por lo que es el soluto. El agua —el componente mayoritario— es el disolvente. El hecho de que la solución resultante sea la misma fase que el agua también sugiere que el agua es el disolvente.
Se elabora una solución disolviendo 3.33 g de\(\ce{HCl(g)}\) en 40.0 g de alcohol metílico líquido (\(\ce{CH3OH}\)). Identificar el solvente y soluto en la solución resultante.
- Contestar
-
soluto: HCl (g); disolvente: CH 3 OH
Al igual que se disuelve
Una forma sencilla de predecir qué compuestos se disolverán en otros compuestos es la frase “como se disuelve como”. Lo que esto significa es que los compuestos polares disuelven los compuestos polares, los compuestos no polares disuelven los compuestos no polares, pero los polares y los no polares no se disuelven entre sí.
Incluso algunas sustancias no polares se disuelven en agua pero sólo en un grado limitado. ¿Alguna vez te has preguntado por qué los peces son capaces de respirar? El gas oxígeno, una molécula no polar, sí se disuelve en el agua y es este oxígeno el que los peces absorben a través de sus branquias. O bien, un ejemplo más de un compuesto no polar que se disuelve en agua es la razón por la que podemos disfrutar de las sodas carbonatadas. Pepsi-cola y todos los demás refrescos tienen gas dióxido de carbono\(\ce{CO_2}\), un compuesto no polar, disuelto en una solución de azúcar-agua. En este caso, para mantener la mayor cantidad de gas en solución posible, los refrescos se mantienen bajo presión.
Esta tendencia general de “como se disuelve como” se resume en la siguiente tabla:
| Soluto | Solvente | ¿Se forma la solución? |
|---|---|---|
| Covalente Polar | Polar | si |
| Covalente no polar | No polar | si |
| Covalente Polar | No polar | no |
| Covalente no polar | Polar | no |
| Iónico | Polar | si |
| Iónico | No polar | no |
Tenga en cuenta que cada vez que se mezclan partículas cargadas (compuestos iónicos o sustancias polares), se forma una solución. Cuando se mezclan partículas sin cargas (compuestos no polares), formarán una solución. No obstante, si las sustancias con cargas se mezclan con otras sustancias sin cargos no se forma una solución.
Cuando un compuesto iónico se considera “insoluble”, no significa necesariamente que el compuesto esté completamente intacto por el agua. Todos los compuestos iónicos se disuelven hasta cierto punto. Un compuesto insoluble simplemente no se disuelve en ninguna cantidad notable o apreciable.
¿Qué es lo que hace que un soluto sea soluble en algunos solventes pero no en otros?
La respuesta son las interacciones intermoleculares. Las interacciones intermoleculares incluyen fuerzas de dispersión de Londres, interacciones dipolo-dipolo y enlaces de hidrógeno (como se describe en

la sección anterior). A partir de estudios experimentales, se ha determinado que si las moléculas de un soluto experimentan las mismas fuerzas intermoleculares que el disolvente, el soluto probablemente se disolverá en ese disolvente. Entonces, el NaCl—una sustancia muy polar porque está compuesta de iones— se disuelve en agua, que es muy polar, pero no en el petróleo, que generalmente es no polar. La cera no polar se disuelve en hexano no polar, pero no en agua polar. Se dice que los líquidos que se disuelven unos en otros en todas las proporciones son miscibles. Los líquidos que no se disuelven entre sí se denominan inmiscibles.
Figura\(\PageIndex{2}\) El agua (líquido transparente) y el aceite (amarillo) no forman soluciones líquidas. (CC BY-SA 1.0 Genérico; Victor Blacus)
¿Yo 2 sería más soluble en CCl 4 o H 2 O? Explica tu respuesta.
Solución
I 2 es no polar. De los dos disolventes, CCl 4 es no polar y H 2 O es polar, por lo que se esperaría que I 2 fuera más soluble en CCl 4.
¿Sería C 3 H 7 OH más soluble en CCl 4 o H 2 O? Explica tu respuesta.
- Contestar
-
H 2 O porque ambos experimentan enlaces de hidrógeno
El agua se considera un solvente polar. ¿Qué sustancias deben disolverse en agua?
- metanol (CH 3 OH)
- sulfato de sodio (Na 2 SO 4)
- octano (C 8 H 18)
Solución
Debido a que el agua es polar, las sustancias que son polares o iónicas se disolverán en ella.
- Debido al grupo OH en metanol, esperamos que sus moléculas sean polares. Así, esperamos que sea soluble en agua. Como tanto el agua como el metanol son líquidos, se puede usar la palabra miscible en lugar de soluble.
- El sulfato de sodio es un compuesto iónico, por lo que esperamos que sea soluble en agua.
- Al igual que otros hidrocarburos, el octano es no polar, por lo que esperamos que no sea soluble en agua.
El tolueno (C 6 H 5 CH 3) es ampliamente utilizado en la industria como disolvente no polar. ¿Qué sustancias deben disolverse en tolueno?
- agua (H 2 O)
- sulfato de sodio (Na 2 SO 4)
- octano (C 8 H 18)
- Contestar
-
octano (C 8 H 18) se disolverá. También es no polar.
El proceso de disolución
El agua generalmente disuelve la mayoría de los compuestos iónicos y moléculas polares. Las moléculas no polares, como las que se encuentran en la grasa o el aceite, no se disuelven en agua. Primero examinaremos el proceso que ocurre cuando un compuesto iónico, como la sal de mesa (cloruro de sodio), se disuelve en agua.
Las moléculas de agua se mueven continuamente debido a su energía cinética. Cuando se coloca un cristal de cloruro de sodio en el agua, las moléculas del agua chocan con la red cristalina. Recordemos que la red cristalina está compuesta por iones positivos y negativos alternantes. El agua es atraída por el cristal de cloruro de sodio porque el agua es polar; tiene un final tanto positivo como negativo. Los iones de sodio cargados positivamente en el cristal atraen el extremo de oxígeno de las moléculas de agua porque son parcialmente negativas. Los iones cloruro cargados negativamente en el cristal atraen el extremo de hidrógeno de las moléculas de agua porque son parcialmente positivas. La acción de las moléculas polares de agua separa la red cristalina (ver figura abajo).
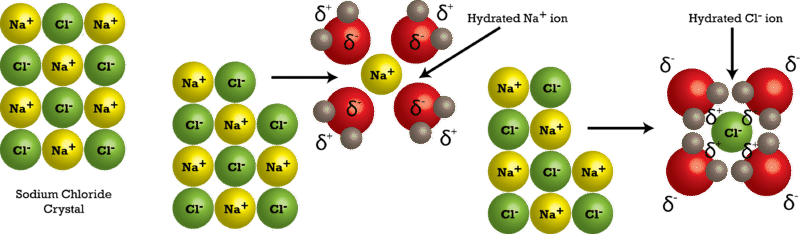
Después de separarse del cristal, los iones individuales son rodeados por partículas de disolvente en un proceso llamado solvatación. Obsérvese en la figura anterior que\(\ce{Na^+}\) los iones individuales están rodeados por moléculas de agua con el átomo de oxígeno orientado cerca del ion positivo. Asimismo, los iones cloruro están rodeados por moléculas de agua con la orientación opuesta. Así, se forman numerosas interacciones ión-dipolo. La hidratación es el proceso de partículas de soluto que están rodeadas por moléculas de agua dispuestas de manera específica. La hidratación ayuda a estabilizar las soluciones acuosas al evitar que los iones positivos y negativos se vuelvan a unir y formen un precipitado.
El azúcar de mesa está hecho del compuesto molecular sacarosa\(\left( \ce{C_{12}H_{22}O_{11}} \right)\). El azúcar sólido consiste en moléculas individuales de azúcar unidas por fuerzas atractivas intermoleculares. Cuando el agua disuelve el azúcar, separa las moléculas individuales de azúcar alterando las fuerzas atractivas, pero no rompe los enlaces covalentes entre los átomos de carbono, hidrógeno y oxígeno. Las moléculas de azúcar disueltas también están hidratadas. La capa de hidratación alrededor de una molécula de sacarosa está dispuesta de manera que sus átomos de oxígeno parcialmente negativos estén cerca de los átomos de hidrógeno parcialmente positivos en el disolvente, y viceversa.
Resumen
- Las soluciones están compuestas por un disolvente (componente principal) y un soluto (componente menor).
- “Como se disuelve como” es una regla útil para decidir si un soluto será soluble en un solvente.
- Se dice que los líquidos que se disuelven unos en otros en todas las proporciones son miscibles.
- Los líquidos que no se disuelven entre sí se denominan inmiscibles.
- Las interacciones ión-dipolo se forman cuando los compuestos iónicos se disuelven en agua.
Colaboradores y Atribuciones
Henry Agnew (UC Davis)
- Libretext: Chemistry for Allied Health (Soult)
- Libretext: The Basics of GOB Chemistry (Ball et al.)

