2.3: Regla de Cram y Regla de Prelog
- Page ID
- 74268
Un carbono carbonilo es s p 2 hibridado. Esto significa que el carbono carbonilo y los otros tres átomos unidos a él estarían en un plano. Un nucleófilo que ataca el carbono carbonilo en moléculas como 1A en la Figura 1.2.1 podría atacar desde cualquier lado de este plano con igual facilidad. Eche un vistazo de cerca al aldehído que se muestra en la Figura 1.2.1.El grupo fenilo también es plano. El ataque nucleofílico al benzaldehído podría ocurrir desde ambos lados con igual facilidad. Dado que ahora se crea un nuevo centro asimétrico por esta reacción, ambos enantiómeros podrían formarse con igual facilidad, dando como resultado una mezcla racémica.
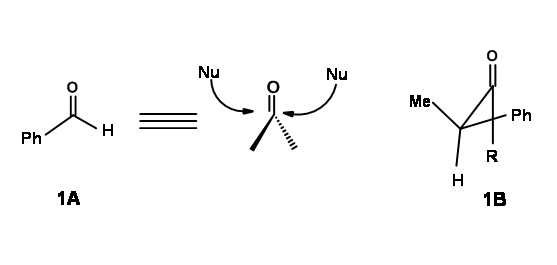
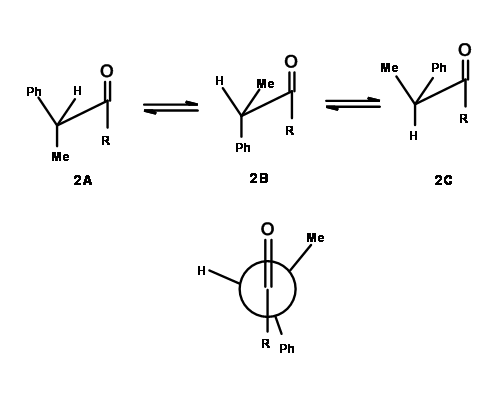
En moléculas orgánicas complejas, esto rara vez ocurre. Cuando el\(\alpha\) carbono es asimétrico (ver 1B), el nucleófilo experimentaría más impedimento estérico desde un lado, lo que llevaría a una síntesis desigual de los dos enantiómeros. Este hecho fue reconocido por primera vez por D. Cram en 1952. Después de analizar varias reacciones publicadas, expuso una explicación basada en una conformación propuesta. Se propuso definir primero una conformación reactiva, como la conformación de menor energía en la que tiene lugar la reacción química. Así, para 1B podría haber varias conformaciones, de las cuales las reacciones químicas prefieren proceder a través de la conformación que tiene la menor cepa estérica (Fig 1.2.2).
Estudios en Estereoquímica. X. La Regla del “Control Estérico de la Inducción Asimétrica” en las Síntesis de Sistemas Acíclicos Donald J. Cram, Fathy Ahmed Abd Elhafez, J.Am. Chem. Soc. 74, 5828 (1952).
Regla de Cram
- El centro asimétrico existente tendría un grupo Pequeño, Medio y Grande, denotados S, M y L respectivamente.
- En la conformación reactiva, el grupo carbonilo se orientaría de tal manera que descansará entre el grupo Pequeño y el Grupo Medio.
- El nucleófilo atacante preferiría atacar desde el lado del grupo pequeño, dando como resultado la formación predominante de un diastereómero en el producto.
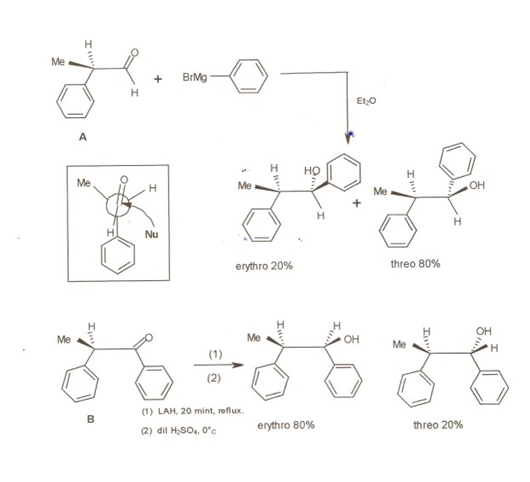
Esto se conoce ahora como Regla de Cram. Cuando el material de partida es un enantiómero puro, la mezcla de productos mostraría predominio de un enantiómero. Apoyó su argumento con un conjunto de sus propios experimentos mostrados en la Figura 1.2.3
El predominio de un diastereómero en tales reacciones podría explicarse sobre la base de las Reglas de Cram. Esta regla demostró ser efectiva para predecir el producto principal en la mayoría de las síntesis asimétricas. Sin embargo, pronto se observaron varias excepciones. Se explicaron con base en argumentos conformacionales adicionales.
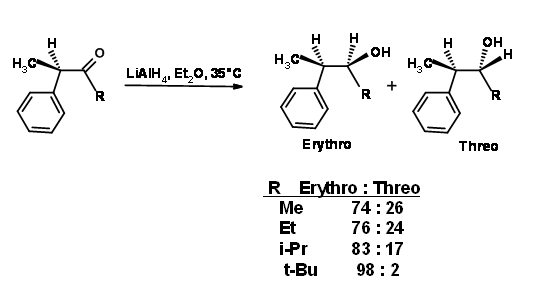
Felkin señaló que las conformaciones reactivas de Cram tuvieron una cepa eclipsante severa entre el grupo R en el centro carbonilo y el grupo L en el carbono - (ver 2B en la Figura 1.2.2). Aumentó progresivamente el grueso del grupo R y observó que el exceso diastereomérico podría oscilar de eritro 74% a treo 96% a medida que aumentaba el volumen (Fig 1.2.4).
- (ver 2B en la Figura 1.2.2). Aumentó progresivamente el grueso del grupo R y observó que el exceso diastereomérico podría oscilar de eritro 74% a treo 96% a medida que aumentaba el volumen (Fig 1.2.4).
Deformación torsional que involucra enlaces parciales. La estereoquímica de la reducción de hidruro de litio y aluminio de algunas cetonas simples de cadena abierta. Marc Cherest, Hugh Felkin y Nicole Prudent Tetraedron Letters, 9, 2199 (1968).
Propuso una conformación escalonada, en donde el nucleófilo se acercó al carbono carbonílico desde el lado menos obstaculizado. La diferencia principal en estos dos enfoques se representa en la Figura 1.2.5.
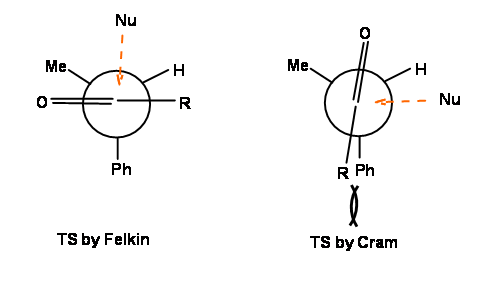
Figura 1.2.5
La falla en el modelo de Felkin es que no es cierto para los aldehídos, donde R=H. Una mejora sobre el modelo de Felkin fue el modelo Felkin-Nguyen (Felkin-Anh), que sugirió que el nucleófilo atacaría el centro s p 2 del carbonilo a 95 Ángulo de 0 a 105 0 relativo al eje del enlace carbonilo, favoreciendo un ataque desde la dirección menos impedida (Figura 1.2.6). Esto difería de los modelos anteriores que sugerían un ataque perpendicular.
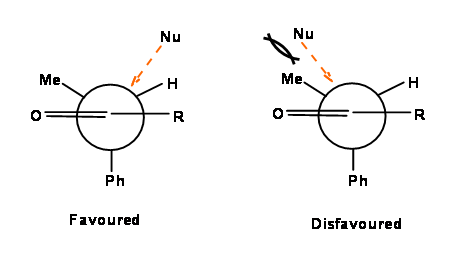
Figura 1.2.6
¿Qué sucede cuando el carbono lleva átomos como 'O', 'N' o 'S'? El primer pensamiento sería que el nucleófilo preferiría el lado opuesto al grupo electronegativo. Esto conduciría a un estado de transición Felkin-Anh. Esto sería cierto solo cuando el reactivo no tenga sitio complejante adicional. Por ejemplo, en borohidruro de sodio el ion sodio no puede proceder de un complejo bivalente. Por otro lado, el borohidruro de zinc podría formar un complejo de quelación divalente entre el oxígeno carbonílico y el átomo electronegativo. Esto se llama complejo Cram-quelación, que conduce a un producto Cram-quelato. Los tres argumentos discutidos hasta el momento se muestran en la Figura 1.2.7.
carbono lleva átomos como 'O', 'N' o 'S'? El primer pensamiento sería que el nucleófilo preferiría el lado opuesto al grupo electronegativo. Esto conduciría a un estado de transición Felkin-Anh. Esto sería cierto solo cuando el reactivo no tenga sitio complejante adicional. Por ejemplo, en borohidruro de sodio el ion sodio no puede proceder de un complejo bivalente. Por otro lado, el borohidruro de zinc podría formar un complejo de quelación divalente entre el oxígeno carbonílico y el átomo electronegativo. Esto se llama complejo Cram-quelación, que conduce a un producto Cram-quelato. Los tres argumentos discutidos hasta el momento se muestran en la Figura 1.2.7.
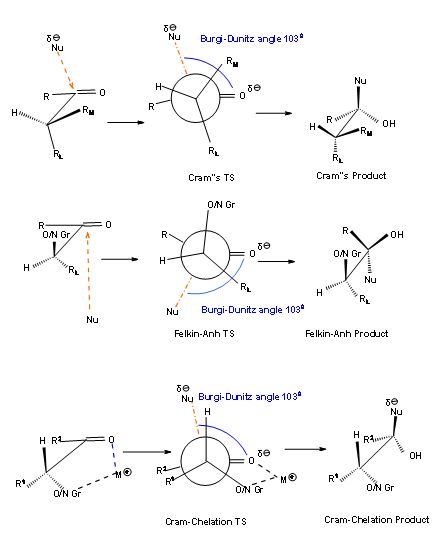
Figura 1.2.7
Dos ejemplos se muestran en la Figura 1.2.8 para representar que el control de quelación de Cram podría conducir a una inversión en la selectividad. A pesar de estos refinamientos a la Regla original de Crams, el hecho es que esta línea de extender los argumentos conformacionales a conformaciones reactivas sugeridas por Cram ha dado como resultado una mayor comprensión de las adiciones nucleofílicas a aldehídos y cetonas.
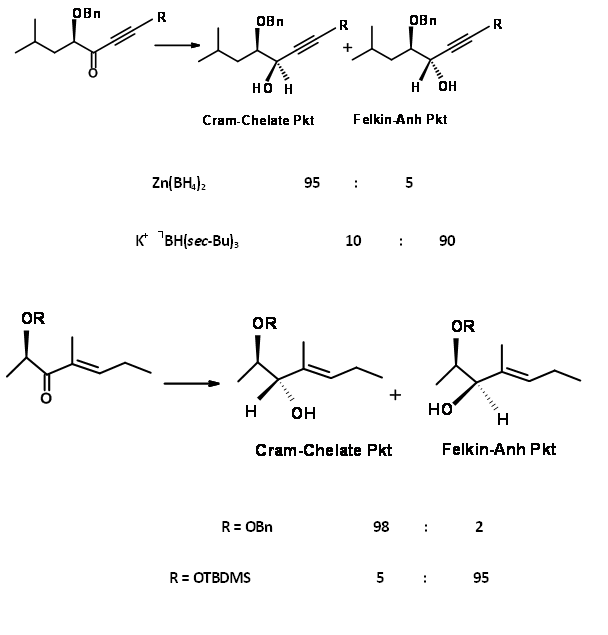
Figura 1.2.8
Regla de Prelog
Una extensión de la idea de Cram de conformación reactiva a ésteres quirales de\(\alpha\) cetoésteres (piruvatos) es la Regla del Prelog reportada en 1953 3. Generalmente se refiere a la adición de Grignard a piruvatos quirales elaborados con alcoholes quirales (Fig 1.2.9).
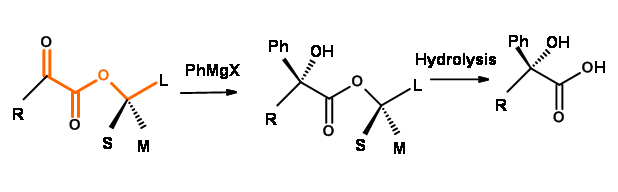
Figura 1.2.9
La regla se ha aplicado para la síntesis asimétrica de\(\alpha\) -hidroxiácidos y para la asignación de la configuración de alcoholes secundarios y terciarios. Se podría racionalizar la disposición anti configuracional\(\alpha\) de los dos restos carbonilo. El extremo negativo de estos dipolos preferiría estar lo más alejado posible. Los dos pares solitarios se sentarían sobre oxígeno éter como los 'Rabit Ears'. El ceto-carbonilo se orientaría entre las dos espigas. Esto colocará los enlaces mostrados en rojo en el mismo plano que el grupo thr ceto-carbonilo. El ataque del lado del grupo pequeño (S) es una extensión de las Reglas de Cram. La inducción asimétrica podría ser a veces pobre debido a la gran distancia entre el centro de reacción y el centro asimétrico induciendo asimetría en el centro quiral en desarrollo.
Referencias
- Prelog V, Helv. Chim. Acta, 36, 308 (1953)

