2.4: Regla de Hofmann y Regla de Zaitsev
- Page ID
- 74277
En reacciones como las reacciones de Metilación Exhaustiva — Eliminación de Hofmann, la olefina menos sustituida generalmente se forma como un producto principal. A esto se le llama la Regla de Hofmann. Todas estas reacciones llevan grupos salientes cargados como —NR 3 + o —SR 2 + e involucran bases fuertes. La Regla de Zaitsev (o regla Saytzeff) llama nuestra atención sobre la posibilidad alternativa. Al eliminar el HX, se obtiene la olefina más estable (Fig 2.3.1). La aparente contradicción en este conjunto de reglas se resuelve fácilmente a través de una mirada crítica a los mecanismos involucrados en estos dos conjuntos de condiciones de reacción.
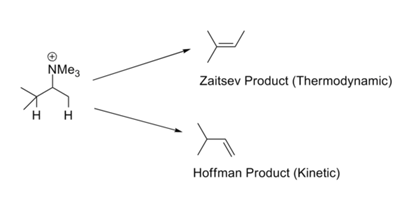
Podría haber dos razones para tales preferencias. Ingold (1960) y Bunnett (1969) sugirieron que un grupo saliente cargado positivamente aumenta la acidez de los protones β. Un sustituyente en la posición β podría disminuir hiperconjugativamente la acidez del protón β. En consecuencia, un grupo metilo terminal (éste no tiene sustituyente alquilo) es más ácido que el protón metino interno (que lleva al menos un sustituyente alquilo). Cuando el grupo saliente es un halógeno, el mecanismo se desplaza hacia E1. En estas condiciones, la estabilidad del doble enlace en desarrollo se vuelve importante y esto lleva a que el producto termodinámicamente sea más estable. La escuela de H.C Brown había sugerido (1956) que los factores estéricos gobiernan tales reacciones de eliminación. Los grupos de salida cargados son grandes en comparación con los grupos de salida neutros.
Los grupos salientes más grandes como —NR 3 + y —SR 2 + dan más producto Hoffmann que grupos más pequeños como halógenos. El volumen de la base también aumenta el producto Hoffmann a costa del producto Zaitsav. La situación parece ser más compleja. Cuando se incrementó la resistencia de la base sin aumentar el volumen en el sitio de reacción (X-C 6 H 4 -O¯), el producto Hoffmann aumentó a costa del producto Zaitsav (Froemsdorf (1966,67)). Esto sugiere un mecanismo E1cb, donde la acidez del protón β es importante. Así, el mecanismo (y por lo tanto la composición de los productos) podría alterarse por factores como el tamaño del grupo saliente, el tamaño de la base, la naturaleza del grupo saliente y la fuerza de la base.

