1.2: Un poco de historia
- Page ID
- 73606
Puede que no te interese mucho la forma en que se desarrolló la química orgánica, pero si saltas a la siguiente sección sin seguir leyendo, te perderás algo del sabor de un logro verdaderamente grande, de cómo unos cuantos químicos altamente creativos pudieron, con la ayuda de algunas herramientas simples, determinar las estructuras de moléculas, demasiado pequeñas y demasiado esquivas para ser vistas individualmente con el mejor microscopio óptico, manifestándose solo por el comportamiento colectivo de al menos millones de millones a la vez.
Trate de visualizar los problemas que enfrenta el químico orgánico de hace 100 años. No tendrá más que muestras razonablemente puras de compuestos orgánicos, los químicos comunes de laboratorio de hoy en día, cristalería, balanzas, termómetros, medios de medición de densidades y algunos instrumentos ópticos. También tendrás una teoría relativamente embrionaria de que hay moléculas en esas botellas y que un compuesto difiere de otro porque sus moléculas tienen diferentes miembros o clases de átomos y diferentes arreglos de enlaces. Su tarea será determinar qué tipos y qué números de átomos contienen, es decir, determinar sus fórmulas moleculares. Obviamente, un compuesto con fórmula\(C_2H_6O\) y uno con no\(C_2H_6O_2\) son el mismo compuesto. Pero supongamos que dos compuestos de diferentes fuentes son ambos\(C_2H_6O\). Para decidir si estos son iguales o diferentes podrías olerlos (mucho mejor olfatear que inhalarlos), probarlos (enfáticamente no se recomienda), ver si tienen la misma apariencia y viscosidad (si son líquidos), o usar criterios más sofisticados: punto de ebullición, punto de fusión, densidad o índice de refracción. Otras posibilidades serían ver si ambos tienen la misma solubilidad en agua u otros disolventes y si dan los mismos productos de reacción con diversos reactivos. Por supuesto, todo esto se pone un poco duro cuando los compuestos no son puros y no hay buenas maneras de purificarlos, pero eso es parte del trabajo. Piensa en cómo podrías proceder.
En retrospectiva es sorprendente que en menos de cincuenta años se construyera un enorme, aunque incompleto, edificio de química orgánica estructural a partir de los resultados de reacciones químicas sin determinación de una distancia de enlace simple, y sin teoría electrónica como guía. Curiosamente, todos los desarrollos posteriores de la teoría mecánica cuántica de los enlaces químicos no han alterado este edificio de manera significativa. En efecto, durante mucho tiempo, un objetivo de la mecánica cuántica molecular era simplemente poder corroborar que cuando un químico orgánico dibuja una sola línea entre dos átomos de carbono para demostrar que están unidos, de hecho sabe lo que está haciendo. Y que cuando dibuja dos (o tres) enlaces entre los carbonos para indicar un doble (o triple) enlace, la mecánica cuántica apoya esto también como una idea válida.
Además, cuando se dispusieron de herramientas modernas para determinar estructuras orgánicas que implican medir realmente las distancias entre los átomos, estas proporcionaron una gran comodidad, pero no grandes sorpresas. Sin duda, algunas estructuras resultaron ser incorrectas porque se basaban en pruebas experimentales defectuosas o inadecuadas. Pero, en general, las representaciones tridimensionales modernas de moléculas que concuerdan con mediciones reales de distancias y ángulos de enlace no son en ningún aspecto importante diferentes de los modelos tridimensionales de bola y varilla ampliamente utilizados de moléculas orgánicas, y estos, en esencia en su forma actual, datan desde al menos tan atrás como E. Paterno, en 1869.
¿Cómo se logró todo esto? No por ningún proceso muy sencillo. Sigue la esencia de algunas de las ideas importantes, pero debe quedar claro que lo que realmente ocurrió estuvo lejos de ser sencillo. Se involucró a un grupo diverso de personas; muchas firmemente comprometidas con, si no tener un interés personal en, hipótesis de trabajo anteriores o paradigmas que habían servido como bases útiles para la experimentación anterior, pero que se estaban desmoronando en las costuras porque no podían acomodar los nuevos hechos que guardaban emergentes. Como es habitual en los esfuerzos humanos, la asunción de nuevas y mejores ideas no llegó con la misma rapidez a todos aquellos acostumbrados a pensar de maneras particulares. Para ilustrar, al menos un famoso químico, Berthelot, todavía se utiliza\(HO\) como fórmula para el agua veinticinco años después de que pareciera claro que\(H_2O\) era una mejor opción.
Determinación de Formulas Moleculares
Antes de que se pudieran establecer estructuras de moléculas, tenía que haber un medio para establecer fórmulas moleculares y para ello el concepto clave fue la hipótesis de Avogadro, que puede afirmarse en la forma “volúmenes iguales de gases a la misma temperatura y presión contienen el mismo número de moléculas”. La hipótesis de Avogadro permitió la asignación de pesos moleculares relativos a partir de mediciones de densidades de gas. Entonces, con técnicas analíticas que permiten determinar los porcentajes en peso de los diversos elementos en un compuesto, se hizo posible establecer un conjunto autoconsistente de pesos atómicos relativos. \(^1\)A partir de estos y los pesos moleculares relativos, se pueden asignar fórmulas moleculares. Por ejemplo, si uno encuentra que un compuesto contiene\(22.0 \%\) carbono (peso atómico\(= 12.00\)),\(4.6 \%\) hidrógeno (peso atómico\(= 1.008\)) y\(73.4 \%\) bromo (peso atómico\(= 79.90\)), entonces las proporciones de los números de átomos son\(\left( 22.0/12.00 \right) : \left( 4.6/1.008 \right) : \left( 73.4/79.90 \right) = 1.83:4.56:0.92\). Dividiendo cada uno del último conjunto de números por el más pequeño (\(0.92\)) da\(1.99:4.96:1 \cong 2:5:1\), lo que sugiere una fórmula molecular de\(C_2H_5Br\) o un múltiplo de los mismos. Si sabemos que el gas hidrógeno es\(H_2\) y tiene un peso molecular de\(2 \times 1.008 = 2.016\), podemos comparar el peso de un volumen dado de hidrógeno con el peso del mismo volumen de nuestro desconocido en la fase gaseosa a la misma temperatura y presión. Si la relación experimental de estos pesos resulta ser\(54\), entonces el peso molecular de lo desconocido sería\(2.016 \times 54 = 109\) y la fórmula\(C_2H_5Br\) sería correcta.
Valence
Si asumimos que la molécula se mantiene unida por enlaces químicos, sin saber más, podríamos escribir numerosas estructuras como\(H-H-H-H-H-C-C-Br, H-C-Br-H-H-C-H-H\), y así sucesivamente. Sin embargo, si también sabemos de la existencia de estable\(H_2\), pero no\(H_3\); de estable\(Br_2\), pero no de\(Br_3\); y de estable\(CH_3Br\)\(CH_2Br_2\),\(CHBr_3\), y\(CBr_4\), pero no de\(CH_4Br\),\(CHBr\),\(CBr\), y así sucesivamente, un patrón de lo que se llama valencia emerge. Se verá que todas las fórmulas anteriores son consistentes si los átomos de hidrógeno y los átomos de bromo forman solo un enlace (son univalentes) mientras que los átomos de carbono forman cuatro enlaces (son tetravalentes). Esto puede parecer casi ingenuamente simple hoy en día, pero un considerable período de duda e incertidumbre precedió a la aceptación de la idea de valencias definidas para los elementos que surgieron alrededor de 1852.
Fórmulas estructurales
Si aceptamos hidrógeno y bromo como univalentes y el carbono como tetravalente, podemos escribir
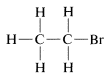
como una fórmula estructural para\(C_2H_5Br\). \(^2\)Sin embargo, también podríamos haber escrito
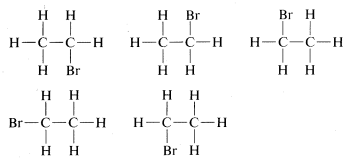
Existe un grave problema en cuanto a si estas fórmulas representan los mismos o diferentes compuestos. Todo lo que se sabía en los primeros días era que cada muestra purificada de\(C_2H_5Br\), no importa cuán preparada, tenía un punto de ebullición\(38^\text{o}C\) y densidad de\(1.460 \: \text{g} \: \text{ml}^{-1}\). Además, todos parecían iguales, todos olían igual y todos sufrieron las mismas reacciones químicas. No hubo evidencia de que\(C_2H_5Br\) fuera una mezcla o que se pudiera preparar más de un compuesto de esta fórmula. Se podría concluir, por lo tanto, que todas las fórmulas estructurales anteriores representan una sola sustancia aunque superficialmente, al menos, se vean diferentes. En efecto, porque\(H-Br\) y\(Br-H\) son dos formas diferentes de escribir una fórmula para una misma sustancia, sospechamos que lo mismo es cierto para
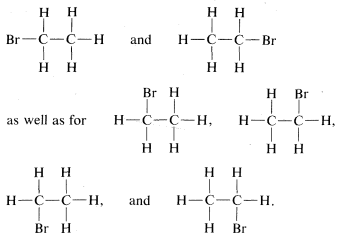
Hay, sin embargo, dos de estas estructuras que podrían ser diferentes entre sí, a saber,
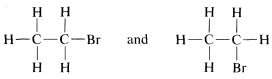
En la primera de ellas,\(CH_3-\) se ubica frente a la\(Br-\) y las\(H-\)'s en el carbono con las\(Br\) también están opuestas entre sí. En la segunda fórmula,\(CH_3-\) y\(Br-\) se localizan uno al lado del otro como son los\(H-\)'s en el mismo carbono. Por lo tanto, tenemos un problema en cuanto a si estas dos fórmulas diferentes también representan compuestos diferentes.
Carbono Tetraédrico
Una brillante solución al problema planteado en la sección anterior llegó en 1874 cuando J. H. van 't Hoff propuso que las cuatro valencias de carbono son equivalentes y dirigidas a las esquinas de un tetraedro regular. \(^3\)Si redibujamos las estructuras para\(C_2H_5Br\) as\(1\), vemos que solo hay una disposición posible y, contrariamente a la impresión que obtuvimos de nuestras fórmulas estructurales anteriores, el bromo se ubica equivalentemente con respecto a cada uno de los hidrógenos en el mismo carbono.
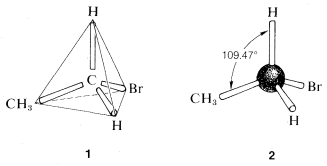
Una manera conveniente de representar moléculas orgánicas en tres dimensiones, que muestra muy claramente las relaciones tetraédricas de los átomos, utiliza los llamados modelos de bola y varilla. Las barras que representan los enlaces o valencias forman los ángulos tetraédricos de\(109.47^\text{o}\).
La cuestión de los isómeros rotacionales
El carbono tetraédrico no resuelve todos los problemas sin postulados adicionales. Por ejemplo, hay dos compuestos diferentes conocidos con la misma fórmula\(C_2H_4Br_2\). Estas sustancias, que llamamos isómeros, pueden escribirse razonablemente como
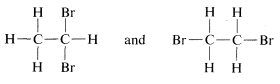
Sin embargo, los modelos de bola y varilla sugieren más posibilidades para la segunda estructura, por ejemplo\(3\)\(4\), y\(5\):
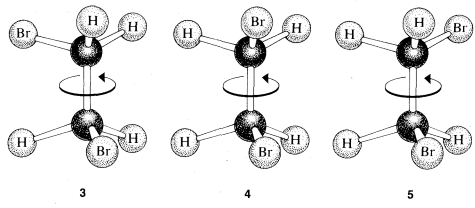
Este es un problema aparentemente reconocido por primera vez claramente por Paterno, en 1869. Llamamos a estos isómeros rotacionales (o conformacionales), porque uno se convierte en otro por la rotación de las mitades de la molécula una respecto a la otra, con el\(C-C\) enlace actuando como eje. Si esto no está claro, deberías hacer un modelo de bola y palo y ver qué hace la rotación alrededor del\(C-C\) enlace a las relaciones entre los átomos en los carbonos.
La dificultad que presentan estas posibilidades finalmente fue eludida por una brillante sugerencia de van 't Hoff de “rotación libre”, que sostiene que los isómeros correspondientes a diferentes ángulos rotacionales, como\(3\),\(4\), y\(5\), no tienen existencia estable separada, sino que son interconvertidos por rotación alrededor del\(C-C\) enlace tan rápidamente que son indistinguibles entre sí. Por lo tanto, solo hay un isómero correspondiente a los diferentes ángulos rotacionales posibles y un total de solo dos isómeros de fórmula\(C_2H_4Br_2\). Como veremos, la idea de libre rotación requirió una amplia modificación unos 50 años después de que se propusiera por primera vez, pero era un paradigma sumamente importante, que, como suele suceder, se enraizó tan profundamente que se convirtió esencialmente en un artículo de fe para los químicos orgánicos posteriores. La rotación libre se discutirá con más detalle en los Capítulos 5 y 27.
El método de sustitución para la prueba de estructura
El problema de determinar si un isómero particular de\(C_2H_4Br_2\) es
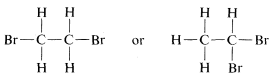
podría resolverse hoy en pocos minutos por medios espectroscópicos, como se explicará en el Capítulo 9. Sin embargo, en el momento en que se estaba desarrollando la teoría de la estructura, la estructura tuvo que deducirse sobre la base de reacciones químicas, que podrían incluir ya sea cómo se formó el compuesto o en qué podría convertirse. Una prueba de estructura prácticamente inatacable, donde es aplicable, es determinar cuántos productos de sustitución diferentes puede dar cada uno de un grupo dado de isómeros. Para el\(C_2H_4Br_2\) par de isómeros, se verá que la sustitución de un bromo por un hidrógeno da solo una posibilidad con un compuesto y dos con el otro:
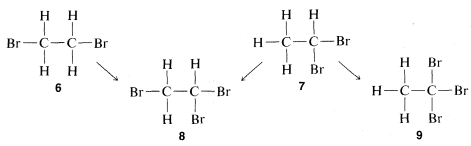
Por lo tanto, si tenemos dos botellas, una que contiene un\(C_2H_4Br_2\) isómero y otra otra y realizamos la prueba de sustitución, el compuesto que da solo un producto es\(6\) y el que da una mezcla de dos productos es\(7\). Además, se verá que la prueba, además de decir qué isómero es\(6\) y cuál es\(7\), establece las estructuras de los dos posibles\(C_2H_3Br_3\) isómeros,\(8\) y\(9\). Así solo se\(8\) puede formar a partir de ambos\(C_2H_4Br_2\) isómeros diferentes mientras que\(9\) se forma a partir de solo uno de ellos.
El problema del benceno
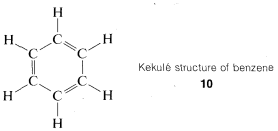
Ya hubo muchas reacciones de interconversión de compuestos orgánicos conocidos en ese momento que la teoría de valencia, fórmulas estructurales y el concepto de carbono tetraédrico entraron en uso general. Como resultado, no pasó mucho tiempo antes de que gran parte de la química orgánica pudiera encajarse en un todo concordante. Un problema difícil lo plantearon las estructuras de un grupo de productos de sustitución del benceno\(C_6H_6\), llamados “compuestos aromáticos”, que durante mucho tiempo desafiaron la explicación. El benceno mismo había sido preparado primero por Michael Faraday, en 1825. Una ingeniosa solución para la estructura del benceno fue proporcionada por A. Kekule, en 1866, donde sugirió (aparentemente como resultado de una percepción alucinatoria) que los seis carbonos estaban conectados en un anillo hexagonal con enlaces alternantes simples y dobles carbono-carbono, y con cada carbono conectado a un hidrógeno simple,\(10\):
Este concepto fue polémico, por decir lo menos, principalmente en dos aspectos. El benceno no se comportó como se esperaba, a juzgar por el comportamiento de otros compuestos con dobles enlaces carbono-carbono y también porque debería haber dos productos de sustitución de dibromo diferentes del benceno con el bromo en los carbonos adyacentes (\(11\)y\(12\)) pero solo uno de esos compuestos podría ser aislado.
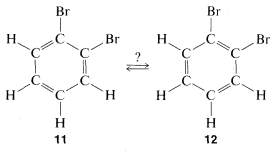
Kekule explicó la segunda objeción al mantener eso\(11\) y\(12\) estaban en rápido equilibrio a través de cambios concertados de bonos, en algo así como la hipótesis de libre rotación mencionada anteriormente:
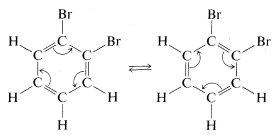
Sin embargo, la primera objeción no pudo ser desestimada tan fácilmente y en los años siguientes se propusieron bastantes estructuras alternativas. La controversia no se resolvió realmente hasta que se estableció que el benceno es un hexágono plano regular, lo que significa que todos sus\(C-C\) enlaces tienen la misma longitud, de acuerdo con una estructura escrita no con doble, no con simple, sino con 1.5 enlaces entre los carbonos, como en\(13\):
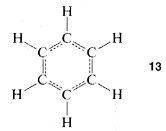
Esto, a su vez, generó una enorme controversia teórica adicional sobre cómo\(13\) debía interpretarse, ¡que, por un tiempo, incluso se convirtió en parte de la política de la “Guerra Fría”! \(^4\)Posteriormente se examinarán aspectos experimentales y teóricos de la estructura del benceno con cierto detalle. Es interesante que a más de 100 años de la propuesta de Kekule aún no se ha contado la historia final sobre la estructura del benceno. \(^5\)
Prueba de estructura a través de reacciones
La combinación de la teoría de valencia y el método de sustitución como se describe en la Sección 1-1F da, para muchos compuestos, pruebas bastante inequívocas de estructura. El uso de transformaciones químicas para pruebas de estructura depende de la aplicabilidad de un simple principio rector, a menudo llamado el "principio de menor cambio estructural”. Como veremos más adelante, se conocen muchas excepciones y se requiere cuidado para evitar cometer errores graves. Con esta precaución, veamos cómo se puede aplicar el principio. El compuesto\(C_2H_5Br\) discutido en la Sección 1-1A reacciona lentamente con agua para dar un producto de fórmula\(C_2H_6O\). La valencia normal del oxígeno es dos, y podemos escribir dos, y solo dos, estructuras diferentes,\(19\) y\(20\), para\(C_2H_6O\):
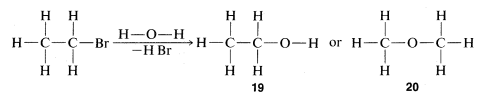
El principio de menor cambio estructural favorece\(19\) como producto, porque la reacción para formarlo es un simple reemplazo del bromo unido al carbono por\(-OH\), mientras que la formación de\(20\) conllevaría un reordenamiento mucho más drástico de los enlaces. El argumento es realmente sutil, implicando una valoración de la razonabilidad de diversas reacciones posibles. En general, sin embargo, funciona bastante bien y, en el caso específico de los\(C_2H_6O\) isómeros, está fuertemente respaldado por el hecho de que el tratamiento\(19\) con ácido bromhídrico fuerte (\(HBr\)) lo convierte de nuevo en\(C_2H_5Br\). Por el contrario, el isómero de estructura\(20\) reacciona con\(HBr\) para formar dos moléculas de\(CH_3Br\):
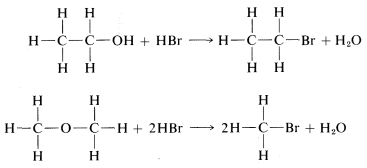
En cada caso, se rompen los\(C-O\)\(C-Br\) vínculos y se forman vínculos.
Podríamos concebir muchas otras posibles reacciones de\(C_2H_6O\) con\(HBr\), por ejemplo
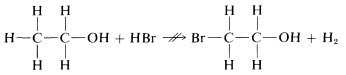
lo que, como indica\(\nrightarrow\), no ocurre, pero difícilmente puede descartarse por el propio principio de menor cambio estructural. Mostrar cómo se puede evaluar la probabilidad de tales reacciones alternativas será una gran parte de nuestras discusiones posteriores.
Reactividad, Saturación, Insaturación y Mecanismos de Reacción
El método de sustitución y las reacciones de interconversión discutidas como prueba de estructura posiblemente pueden darle ideas erróneas sobre las reacciones y reactividad de los compuestos orgánicos. Desde luego, no queremos dar a entender que es un proceso sencillo y directo hacer todos los posibles productos de sustitución de un compuesto como
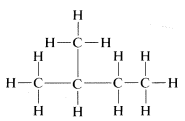
De hecho, como se mostrará más adelante, la sustitución directa de bromo por hidrógeno por compuestos como este no ocurre fácilmente, y cuando ocurre, efectivamente se forman los cuatro posibles productos de sustitución, pero lejos de ser iguales cantidades debido a que existen diferencias en la reactividad para sustitución en las diferentes posiciones. En realidad, algunos de los productos de sustitución se forman sólo en cantidades muy pequeñas. Afortunadamente, esto no destruye la validez del método de sustitución sino que hace que sea más difícil de aplicar. Si la sustitución directa falla, algunos (o todos) de los posibles productos de sustitución pueden tener que producirse por medios indirectos. No obstante, hay que entender que el éxito del método de sustitución depende de la determinación del número total de isómeros posibles, no depende de cómo se preparen los isómeros.
Posteriormente, escuchará mucho sobre compuestos o reactivos que son “reactivos” y “no reactivos”. Es posible que te exaspere la manera floja de que estos términos son utilizados por los químicos orgánicos para caracterizar la rapidez con que ocurren los diversos cambios químicos. Muchas reacciones inorgánicas familiares, como la neutralización del ácido clorhídrico con solución de hidróxido de sodio, son extremadamente rápidas a temperaturas ordinarias. Pero lo mismo no suele ser cierto de las reacciones de los compuestos orgánicos. Por ejemplo,\(C_2H_5Br\) tratado de dos maneras diferentes se convierte en compuestos gaseosos, uno que tiene la fórmula\(C_2H_6\) y el otro\(C_2H_4\). El\(C_2H_4\) compuesto, el eteno, reacciona muy rápidamente con el bromo para dar\(C_2H_4Br_2\), pero el\(C_2H_6\) compuesto, etano, no reacciona con el bromo excepto a altas temperaturas o cuando se expone a la luz solar (o luz intensa similar). Los productos de reacción son entonces\(HBr\) y\(C_2H_5Br\), y más tarde,\(HBr\) y\(C_2H_4Br_2\),\(C_2H_3Br_3\), y así sucesivamente.
Claramente podemos caracterizarnos\(C_2H_4\) como “reactivos” y\(C_2H_6\) como “no reactivos” hacia el bromo. Los primeros químicos orgánicos también utilizaron los términos “insaturado” y “saturado” para este comportamiento, y estos términos todavía se usan ampliamente hoy en día. Pero necesitamos distinguir entre “insaturado” y “reactivo”, y entre “saturado” y “no reactivo”, porque estos pares de términos no son sinónimos. Las ecuaciones para las reacciones de eteno y etano con bromo son diferentes en que el eteno agrega bromo,\(C_2H_4 + Br_2 \rightarrow C_2H_4Br_2\), mientras que el etano sustituye al bromo,\(C_2H_6 + Br_2 \rightarrow C_2H_5Br + HBr\).
Debe reservar el término “insaturado” para compuestos que pueden, al menos potencialmente, reaccionar por adición, y “saturados” para compuestos que solo se puede esperar que reaccionen por sustitución. La diferencia entre adición y sustitución se hizo mucho más clara con el desarrollo de la teoría de la estructura que pedía que el carbono fuera tetravalente y el hidrógeno univalente. Luego se le asignó al eteno una estructura con un doble enlace carbono-carbono, y al etano una estructura con un enlace sencillo carbono-carbono:
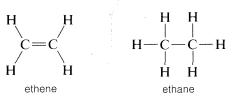
La adición de bromo al eteno se formuló posteriormente como romper uno de los enlaces carbono-carbono del doble enlace y unir bromo a estas valencias. La sustitución se escribió de manera similar pero aquí están involucrados bromo y un\(C-H\) vínculo:
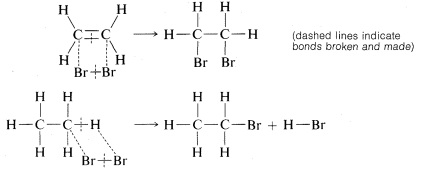
Veremos más adelante que la forma en que realmente ocurren estas reacciones es mucho más complicada de lo que indican estas simples ecuaciones. De hecho, tales ecuaciones son consideradas mejor como operaciones de contabilidad química. El número de enlaces se muestra correctamente tanto para los reactivos como para los productos, y hay una indicación de qué enlaces se rompen y qué enlaces se forman en el proceso general. No obstante, no cometas el error de suponer que ningún otro vínculo se rompe o se hace en etapas intermedias de la reacción.
Gran parte de lo que viene más adelante en este libro se referirá a lo que conocemos, o podemos averiguar, sobre los mecanismos de tales reacciones, siendo un mecanismo de reacción la secuencia real de eventos por los cuales los reactivos se convierten en los productos. Dicha información es de extraordinario valor para definir y comprender el rango de aplicabilidad de reacciones dadas para preparaciones prácticas de compuestos deseados.
La distinción que hemos hecho entre “insaturado” y “reactivo” se ilustra mejor con un ejemplo definido. El eteno es “insaturado” (y “reactivo”) hacia el bromo, pero el tetracloroeteno\(C_2Cl_4\),, no agregará bromo en absoluto bajo las mismas condiciones y es claramente “no reactivo”. Pero ¿también está “saturado”?
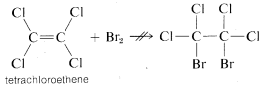
La respuesta es definitivamente no, porque si añadimos una pequeña cantidad de bromuro de aluminio\(AlBr_3\),, a una mezcla de tetracloroeteno y bromo, la adición sí ocurre, aunque lenta:
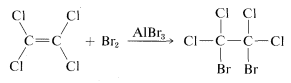
Obviamente, el tetracloroeteno es “insaturado” en el sentido de que puede sufrir adición, aunque no sea reactivo al bromo en ausencia de bromuro de aluminio.
El bromuro de aluminio funciona en la adición de bromo a tetracloroeteno como catalizador, lo cual es algo que facilita la conversión de reactivos en productos. El estudio de la naturaleza y usos de los catalizadores nos preocupará a lo largo de este libro. La catálisis es nuestro principal medio de controlar las reacciones orgánicas para ayudar a formar el producto que queremos en el menor tiempo posible.
\(^1\)Vamos a finura aquí la larga e importante lucha de conseguir una tabla verdaderamente autoconsistente de pesos atómicos. Si te interesa la compleja historia de este problema y la clara solución a la misma propuesta por S. Cannizzaro en 1860, hay muchos relatos disponibles en libros sobre la historia de la química. Un ejemplo es J. R. Partington, A History of Chemistry, Vol. IV, Macmillan, Londres, 1964. Los pesos atómicos relativos ahora se basan en\(^{12}C = 12\) (exactamente).
\(^2\)Fórmulas como esta parecen haber sido utilizadas primero por Crum Brown, en 1864, después de que los originadores de fórmulas estructurales, A. Kekule y A. Couper (1858), surgieran representaciones bastante incómodas, poco prácticas. Parece increíble hoy que incluso el dibujo de estas fórmulas fue duramente criticado durante muchos años. La olla se mantuvo hirviendo principalmente por H. Kolbe, un productivo químico alemán con un don para invectiva colorida y la ventaja de un podio proporcionado por ser editor de una influyente revista química.
\(^3\)El nombre de J. A. Le Bel también está asociado a esta idea en particular, pero el registro muestra que Le Bel en realidad se opuso a las formulaciones tetraédricas, aunque, simultáneamente con van 't Hoff, hizo una contribución relacionada muy importante, como se discutirá en el Capítulo 5.
\(^4\)La “teoría de la resonancia”, que se discutirá en detalle en los capítulos 6 y 21, se caracterizó en 1949 como una teoría física e ideológicamente inadmisible formulada por “científicos burgueses decadentes”. Véase L. R. Graham, Ciencia y filosofía en la Unión Soviética, Vintage Books, Nueva York, 1973, capítulo VIII, para un interesante relato de esta controversia.
\(^5\)La química orgánica moderna no debe considerarse en absoluto como una ciencia asentada, libre de controversia. Sin duda, a menudo no se publican ataques personales del tipo de los que se entregan Kolbe y otros, pero existen profundas y de hecho amargas diferencias de interpretación científica y pueden persistir durante muchos años.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


