4.6: Halogenaciones prácticas y problemas de selectividad
- Page ID
- 72729
Dado el conocimiento de que una reacción particular procederá a una velocidad adecuada, son necesarias una serie de consideraciones prácticas para una operación satisfactoria. Estas consideraciones incluyen la interferencia por posibles reacciones secundarias que dan productos distintos a los deseados, la facilidad de separación del producto deseado de la mezcla de reacción y los costos de materiales, aparatos y mano de obra. Consideraremos estos problemas en relación con las importantes reacciones sintéticas discutidas en este libro.
La cloración de hidrocarburos saturados puede ser inducida por la luz, pero también se puede llevar a cabo a temperaturas de aproximadamente\(300^\text{o}\) en la oscuridad. En tales circunstancias el mecanismo es similar al de la cloración inducida por la luz, excepto que los átomos de cloro se forman por disociación térmica de moléculas de cloro. Las superficies de carbono sólido catalizan la cloración térmica, posiblemente al contribuir a la escisión de las moléculas de cloro.
La monohalogenación directa de hidrocarburos saturados funciona satisfactoriamente solo con cloro y bromo. Para la reacción general

el\(\Delta H^\text{0}\) valor calculado es negativo y muy grande para flúor, negativo y moderado para cloro y bromo, y positivo para yodo (ver Cuadro 4-7). Con flúor, la reacción evoluciona tanto calor que puede ser difícil de controlar, y se pueden obtener productos de la escisión de enlaces carbono-carbono así como de enlaces carbono-hidrógeno. El único procedimiento exitoso de fluoración directa para hidrocarburos implica la difusión de cantidades diminutas de flúor mezclado con helio en hidrocarburos líquidos o sólidos a bajas temperaturas, típicamente\(-78^\text{o}\) (temperatura de Hielo Seco). A medida que avanza la fluoración, se puede aumentar la concentración de flúor. El proceso es el más adecuado para la preparación de compuestos completamente fluorados, y ha sido posible obtener de esta manera cantidades de\(\left( CF_3 \right)_4C\) y a\(\left( CF_3 \right)_3 C-C \left( CF_3 \right)_3\) partir de 2,2-dimetilpropano y 2,2,3,3-tetrametilbutano correspondientes a\(10\) -\(15\%\) rendimientos basados en el flúor utilizado.
El bromo generalmente es mucho menos reactivo hacia los hidrocarburos que el cloro, tanto a altas temperaturas como con activación por luz. Sin embargo, por lo general es posible bromar hidrocarburos saturados con éxito. El yodo no es reactivo.
| Halógeno (X) | \(\Delta H^o\)(kcal/mol) a |
|---|---|
| F | \ (\ Delta H^O\) (kcal/mol) a” style="text-align:center; ">-116 |
| Cl | \ (\ Delta H^O\) (kcal/mol) a” style="text-align:center; ">-27 |
| Br | \ (\ Delta H^O\) (kcal/mol) a” style="text-align:center; ">-10 |
| I | \ (\ Delta H^O\) (kcal/mol) a” style="text-align:center; ">13 |
| a Calculado a partir de las energías de enlace del Cuadro 4-3. | \ (\ Delta H^o\) (kcal/mol) a"> |
La cloración del metano no tiene que detenerse con la formación de clorometano (cloruro de metilo). Es habitual al clorar metano para obtener algunos de los productos de mayor cloración: diclorometano (cloruro de metileno), triclorometano (cloroformo) y tetraclorometano (tetracloruro de carbono):
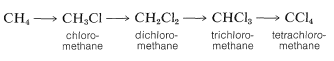
En la práctica, se puede controlar el grado de sustitución en gran medida controlando la relación metano-cloro. Por ejemplo, para que predomine la monocloración, es necesaria una alta relación metano-cloro de tal manera que los átomos de cloro reaccionen con\(CH_4\) y no con\(CH_3Cl\).
Selectividad en Halogenación de Alcanos
Para propano e hidrocarburos superiores para los que generalmente es posible más de un producto de monosustitución, surgen problemas de separación difíciles cuando se desea un producto en particular. Por ejemplo, la cloración de 2-metilbutano\(3\)\(300^\text{o}\) da los cuatro posibles productos de monosustitución\(4\),\(5\),\(6\), y\(7\):
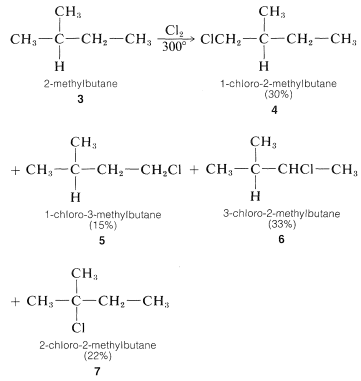
Sobre una base puramente estadística, podemos esperar que la relación de productos se\(3\) correlacione con el número de hidrógenos disponibles en las diversas posiciones de sustitución. Es decir,\(4\),\(5\),\(6\), y se\(7\) formaría en la proporción 6:3:2:1 (\(50\%\):\(25\%\):\(17\%\):\(8\%\)). Sin embargo, como puede verse en la Tabla 4-6, las resistencias de los enlaces de hidrógeno a los carbonos primario, secundario y terciario no son las mismas y, a partir del argumento dado en la Sección 4-4E esperaríamos que los\(C-H\) enlaces más débiles fueran atacados preferencialmente por\(Cl \cdot\). La proporción de\(7\) formados es aproximadamente tres veces la esperada sobre una base estadística, lo que está de acuerdo con nuestra expectativa de que el\(C-H\) enlace terciario del 2-metilbutano sea el más débil de los\(C-H\) enlaces. (Ver Cuadro 4-6.)
Los factores que rigen la selectividad en la halogenación de alcanos siguen:
1. Las velocidades a las que se rompen los diversos\(C-H\) enlaces del 2-metilbutano por el ataque de los átomos de cloro se aproximan a 1:1:1 a medida que la temperatura se eleva por encima\(300^\text{o}\). A temperaturas más altas tanto los átomos de cloro como los hidrocarburos se vuelven más reactivos debido al incremento en sus energías térmicas. En última instancia, se alcanzan temperaturas donde un átomo de cloro elimina esencialmente el primer hidrógeno con el que colisiona independientemente de la posición en la cadena hidrocarbonada. En tales circunstancias, la composición de los productos de monocloración corresponderá a la esperada de las estadísticas simples.
2. Los átomos de bromo son mucho más selectivos que los átomos de cloro. Esto no es inesperado porque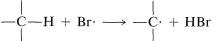 es endotérmico, mientras que las reacciones correspondientes con átomos de cloro suelen ser exotérmicas (datos de la Tabla 4-6). El bromo elimina solo aquellos hidrógenos que están relativamente débilmente unidos a un átomo de carbono. Como se predijo,\(Br \cdot\) el ataque de 2-metilbutano conduce principalmente a 2-bromo-2-metilbutano, algo de bromuro secundario, y esencialmente no bromuros primarios:
es endotérmico, mientras que las reacciones correspondientes con átomos de cloro suelen ser exotérmicas (datos de la Tabla 4-6). El bromo elimina solo aquellos hidrógenos que están relativamente débilmente unidos a un átomo de carbono. Como se predijo,\(Br \cdot\) el ataque de 2-metilbutano conduce principalmente a 2-bromo-2-metilbutano, algo de bromuro secundario, y esencialmente no bromuros primarios:

3. La selectividad de las reacciones de cloración llevadas a cabo en solución se incrementa notablemente en presencia de benceno o bencenos sustituidos con alquilo debido a que el benceno y otros arenos forman complejos sueltos con átomos de cloro. Esto reduce sustancialmente la reactividad de los átomos de cloro, haciendo que los átomos de cloro se comporten más como átomos de bromo.
Iniciación química de la sustitución de cadena radical
Es posible lograr la cloración de alcanos usando cloruro de sulfurilo (\(SO_2Cl_2\), pb\(69^\text{o}\)) en lugar de cloro:
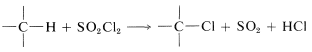
La reacción tiene un mecanismo radical-cadena y las cadenas pueden ser iniciadas por la luz o por productos químicos, generalmente peróxidos,\(ROOR\). La iniciación química requiere de un iniciador con un enlace débil que se disocie a temperaturas entre\(40\) -\(80^\text{o}\). Los peróxidos son buenos ejemplos. El\(O-O\) enlace es muy débil (\(30\)-\(50 \: \text{kcal}\)) y al calentarse se disocia a radicales alcoxilo\(RO \cdot\), que son lo suficientemente reactivos para generar los radicales propagadores de cadena a partir de los reactivos. No siempre se conoce la secuencia exacta de iniciación química, pero una ruta plausible en el presente caso tendría hidrógeno\(RO \cdot\) abstracto del alcano:
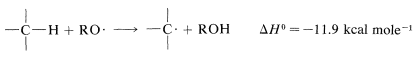
Los pasos de propagación que seguirían son
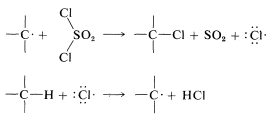
La cloración con cloruro de sulfurilo de alcanos con más de un tipo de hidrógeno da una mezcla de cloruros de alquilo que se asemeja a la obtenida con el cloro mismo. Sin embargo, en algunas circunstancias la mezcla de cloruros no es la misma mezcla obtenida con el cloro mismo y cuando esto es cierto, la etapa de abstracción de hidrógeno probablemente implica\(\cdot SO_2Cl\) más que\(Cl \cdot\). Las etapas alternativas de propagación son entonces
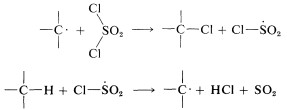
Se esperan diferentes relaciones de producto de\(Cl \cdot\) y\(ClSO_2 \cdot\) por la misma razón que\(Cl \cdot\) y\(Br \cdot\) conducen a diferentes proporciones de producto (Sección 4-5A). Otros reactivos que a veces son agentes halogenantes útiles en reacciones de cadena radical incluyen

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


