5.3: Isómeros conformacionales
- Page ID
- 73634
Cuando se utilizan modelos de bola y varilla, si se permite que los palos giren en los agujeros, se encontrará que para el etano\(CH_3-CH_3\), es posible un número infinito de diferentes orientaciones atómicas, dependiendo de la relación angular (el llamado ángulo torsional) entre los hidrógenos en cada carbono. En la Figura 5-5 se muestran dos orientaciones o conformaciones extremas. En las vistas finales de los modelos, se ve que la conformación eclipsada tiene los hidrógenos en el carbono delantero directamente frente a los del carbono posterior. La conformación escalonada tiene cada uno de los hidrógenos en el carbono delantero establecido entre cada uno de los hidrógenos en el carbono posterior. No ha sido posible obtener muestras separadas de etano que correspondan a estas u orientaciones intermedias porque las moléculas de etano reales parecen tener esencialmente “rotación libre” alrededor del enlace simple que une los carbonos. La rotación libre, o al menos rápida, es posible alrededor de todos los enlaces\(C-C\) simples, excepto cuando los carbonos son parte de un anillo como en el ciclopropano o ciclohexano.
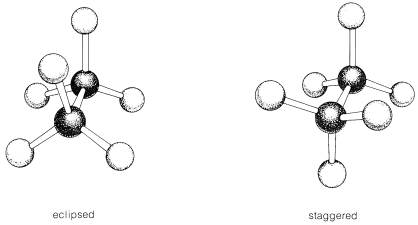
Para el etano y sus derivados, las conformaciones escalonadas son más estables que las conformaciones eclipsadas. La razón de esto en etano no está del todo clara, pero sin duda depende de que, en la conformación escalonada, los electrones de\(C-H\) unión están lo más lejos posible entre sí y dan la menor repulsión interelectrónica. Con grupos mayores que los átomos de hidrógeno sustituidos en carbonos de etano, los modelos de relleno de espacio generalmente muestran menos interferencia (impedimento estérico) para conformaciones escalonadas que para conformaciones eclipsadas.
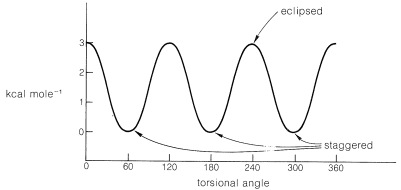
La diferencia energética entre etano eclipsado y escalonado es aproximadamente\(3 \: \text{kcal mol}^{-1}\). \(^4\)Esto se muestra en la Figura 5-6 como la altura de los picos (formas eclipsadas) que separan los valles (formas escalonadas) en una curva que muestra la energía potencial del etano a medida que los grupos metilo rotan uno con respecto al otro a través\(360^\text{o}\). La rotación entonces no es estrictamente “libre” porque hay una\(3\) - barrera\(\text{kcal mol}^{-1}\) energética que superar al eclipsar a los hidrógenos. Aun así, la barrera es lo suficientemente baja como para que la rotación sea muy rápida a temperatura ambiente, ocurriendo del orden de\(10^{10}\) veces por segundo.
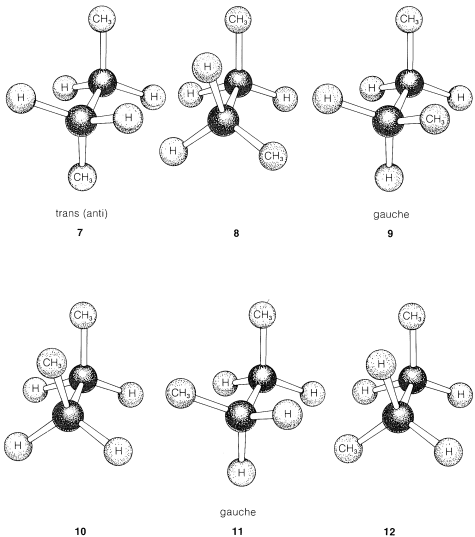
En butano,\(CH_3CH_2CH_2CH_3\), una\(360^\text{o}\) rotación alrededor del\(C-C\) enlace central permite que la molécula pase a través de tres arreglos eclipsados diferentes (\(8\)\(10\),,\(12\)), y tres arreglos escalonados diferentes (\(7\),,\(11\))\(9\), como se muestra en la Figura 5-7. El experimento muestra que el butano favorece la forma escalonada\(7\) en la que los grupos metilo están más alejados. Esta forma se llama la conformación anti (o trans) (a veces conformador), y\(63\%\) de las moléculas de butano existen en esta forma a temperatura ambiente. Las otras dos formas escalonadas\(9\) y\(11\) se denominan conformaciones gauche (syn o sesgo) y tienen un ángulo torsional de\(60^\text{o}\) entre los dos grupos metilo. Las formas\(9\) y\(11\) en realidad son imágenes especulares no identicas, pero la rotación del enlace es tan rápida que las conformaciones enantioméricas separadas no se pueden aislar. Las poblaciones de las dos formas gauches son iguales a temperatura ambiente (\(18.5\%\)de cada una) por lo que cualquier rotación óptica causada por una forma se cancela exactamente por una rotación opuesta causada por la otra.
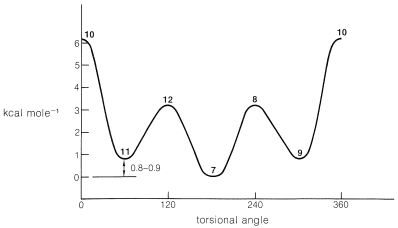
Las poblaciones de las formas eclipsadas de butano, como las formas eclipsadas del etano, son pequeñas y representan máximos de energía para la molécula a medida que se produce la rotación alrededor del\(C-C\) enlace central. Las diferencias de energía entre las conformaciones de butano se representan diagramáticamente en la Figura 5-8. Los valles corresponden a formas escalonadas y la diferencia de energía entre las formas anti y gauche es\(0.8\) -\(0.9 \: \text{kcal mol}^{-1}\).
Un trabajo pionero en el campo del análisis conformacional fue aportado por O. Hassel (Noruega) y D. R. H. Barton (Gran Bretaña), por lo que compartieron el Premio Nobel de Química en 1969. El trabajo de Hassel involucró la determinación física de conformaciones preferidas de moléculas pequeñas, mientras que Barton fue el primero en mostrar la importancia general de la conformación a la reactividad química. El estudio de conformaciones y equilibrios conformacionales tiene aplicación directa para explicar la extraordinaria especificidad que exhiben los compuestos de importancia biológica. Los compuestos de los sistemas vivos están hechos a medida para realizar funciones altamente específicas o incluso únicas en virtud de sus configuraciones y conformaciones particulares.
\(^4\)Esto no es de ninguna manera una cantidad trivial de energía: la diferencia de energía entre las formas escalonadas y eclipsadas de\(1 \: \text{mol}\) (\(30 \: \text{g}\)) de etano es suficiente para calentar el agua\(30 \: \text{g}\) de\(0^\text{o}\) a\(100^\text{o}\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


