5.5: El Convenio D, L para Designación de Configuraciones Estereoquímicas
- Page ID
- 73656
Señalamos en el Capítulo 3 la importancia de usar nombres sistemáticos para compuestos de tal manera que el nombre describa de manera única la estructura. Es igualmente importante poder describir sin ambigüedades la configuración de un compuesto. La convención que se utiliza para designar las configuraciones de carbonos quirales de compuestos naturales se denomina\(D, L\) sistema. Para usarlo, vemos la molécula de interés de acuerdo con las siguientes reglas:
1. La cadena principal de carbono está orientada verticalmente con el carbono numerado más bajo en la parte superior. La numeración utilizada para este fin deberá seguir las reglas de la IUPAC:
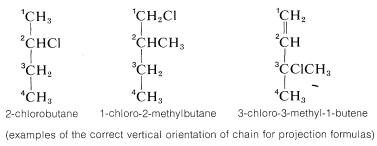
2. A continuación, la estructura debe estar dispuesta en el carbono quiral particular cuya configuración se va a asignar para que los enlaces horizontales a ese carbono se extiendan hacia usted y los enlaces verticales se extiendan lejos de usted. Esta disposición se verá precisamente la misma que la convención de fórmulas de proyección como\(5c\) y\(6c\) (Sección 5-3C).
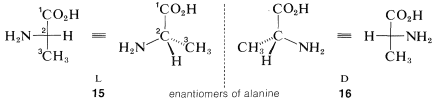
3. Ahora se examinan las posiciones relativas de los sustituyentes en los enlaces horizontales en los centros quirales. Si el sustituyente principal es el izquierdo de la cadena principal, se asigna la\(L\) configuración; si este sustituyente está a la derecha, se asigna la\(D\) configuración.
Por ejemplo, las dos configuraciones del aminoácido, alanina, estarían representadas en perspectiva o proyección como\(15\) y\(16\). El carbono carboxilo es\(C1\) y se coloca en la parte superior. Los sustituyentes en el carbono quiral conectado a los enlaces horizontales son amino (\(-NH_2\)) e hidrógeno. El sustituyente amino se toma como el sustituyente principal; cuando éste está a la izquierda el ácido tiene la\(L\) configuración, y cuando está a la derecha, la\(D\) configuración. Se ha demostrado que todos los aminoácidos que se presentan en las proteínas naturales tienen la\(L\) configuración.
El gliceraldehído\(CH_2OHCHOHCHO\), que tiene un carbono quiral unido a una función aldehído, hidrógeno, hidroxilo e hidroximetilo (\(CH_2OH\)), es de especial interés como el prototipo quiral más simple de azúcares (carbohidratos). Las vistas en perspectiva y las proyecciones Fischer de las\(L\) formas\(D\)\(17\) y corresponden a y\(18\), respectivamente, donde el carbono de la función aldehído (\(-CH=O\)) es\(C1\):
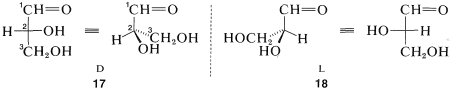
El\(D,L\) sistema de designación de configuración solo se puede aplicar cuando hay una cadena principal, y cuando podemos hacer una elección inequívoca de los grupos sustituyentes principales. Intentar, por ejemplo, asignar\(D\) y\(L\) configuraciones a enantiómeros de bromoclorofluorometano. Se ha elaborado un excelente conjunto de reglas para tales casos que lleva a asignaciones configuracionales inequívocas por lo que se llama la \(R,S\)convención. Discutimos el\(R,S\) sistema en detalle en el Capítulo 19 y, si lo desea, puede recurrir a él ahora. Sin embargo, para los siguientes capítulos, asignar configuraciones es mucho menos importante para nosotros que saber qué tipos de estereoisómeros son posibles.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


