5.6: Moléculas con Más de un Centro Quiral. Diastereómeros
- Page ID
- 73626
Hemos visto ejemplos de moléculas con un centro quiral que existen en dos configuraciones de imagen especular, a las que llamamos enantiómeros. ¿Qué sucede cuando hay más de un centro quiral? ¿Cuántos estereoisómeros debemos esperar? Considere los estereoisómeros del aminoácido importante, la treonina, (ácido 2-amino-3-hidroxibutanoico). Para esta sustancia, si escribimos todas las configuraciones posibles de sus dos carbonos quirales, tenemos cuatro fórmulas de proyección diferentes,\(19\) -\(22\), correspondientes a cuatro estereoisómeros diferentes:
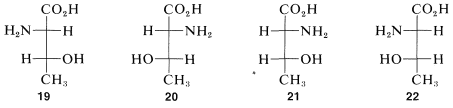
Debido a que cada centro quiral agregado a una cadena duplica el número de configuraciones posibles, esperamos ocho estereoisómeros diferentes con tres carbonos quirales, dieciséis con cuatro, y así sucesivamente, la regla simple es\(2^n\) posible diferentes estereoisómeros para centros\(n\) quirales. Como veremos más adelante, esta regla tiene que ser modificada en algunos casos especiales.
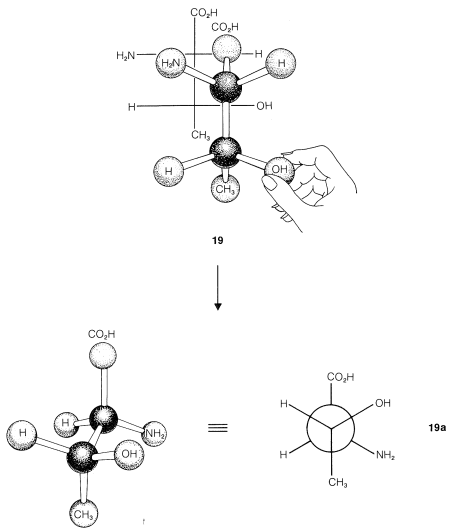
¿Cuál es la relación entre los estereoisómeros\(19\) -\(22\)? Esto quedará más claro si traducimos cada una de las fórmulas de proyección en una representación tridimensional, como se muestra en la Figura 5-13. Te ayudarán mucho si trabajas tú mismo a través de la secuencia con un modelo de bola y palo. Dibujado como proyecciones de Newman,\(19\) -\(22\) salen como se muestra en\(19a\) -\(22a\):
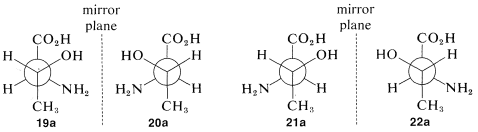
Debe quedar claro (y, si no lo es, los modelos de bola y palo serán invaluables) que\(19a\) y (20a\) son imágenes especulares entre sí y eso\(21a\) y\(22a\) son igualmente imágenes especulares. \(^5\)¿Qué pasa con otras combinaciones como\(19a\) y\(21a\) o\(20a\) y\(22a\)? Si miras a las parejas de cerca encontrarás que no son imágenes especulares y no son idénticas. Tales sustancias, relacionadas entre sí de esta manera y que pueden convertirse una en otra sólo cambiando las configuraciones en uno o más centros quirales, se denominan diastereómeros.
La diferencia entre enantiómeros y diastereómeros es más que solo geometría. Los diastereómeros tienen propiedades químicas y físicas sustancialmente diferentes, mientras que los enantiómeros tienen propiedades físicas idénticas (aparte de sus rotaciones ópticas). Esto se ilustra en la Tabla 5-1 para los estereoisómeros de treonina. La razón de la diferencia de propiedades físicas entre diastereómeros se puede ver de manera muy simple para una sustancia con dos centros quirales al señalar que un zapato derecho sobre un pie derecho (\(D,D\)) es una imagen especular, o tiene las mismas propiedades físicas, como un zapato izquierdo en un pie izquierdo (\(L,L\)), pero no es un imagen especular, ni tiene las mismas propiedades físicas, como un show izquierdo en un pie derecho (\(L,D\)), o un zapato derecho en un pie izquierdo (\(D,L\)).
Meso Compuestos (Diastereómeros Aquirales)
Todos los estereoisómeros de treonina\(19\)\(22\) -son sustancias quirales; es decir, no son idénticos a sus imágenes especulares. Sin embargo, es importante reconocer que no todos los diastereómeros son quirales. Para ilustrar este punto, volvemos a los ácidos tartáricos mencionados anteriormente en relación con los descubrimientos de Pasteur (Sección 5-1C).

Procediendo como hicimos para la treonina, podemos escribir cuatro fórmulas de proyección para ácido tartárico, ácido 2,3-dihidroxibutanodioico, como se muestra por\(23\) -\(26\):
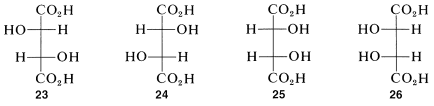
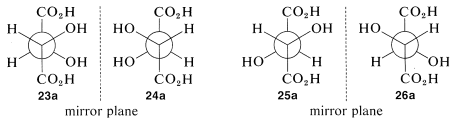
Hay dos pares de imágenes especulares\(23a\) y\(24a\), así como\(25a\) y\(26a\). No obstante, lo que no quedará tan claro de inmediato, sino lo que debes verificar por ti mismo es eso\(25a\) y\(26a\) son, de hecho, idénticos. Esto significa que\(25a\) y\(26a\) son representaciones de una sola sustancia aquiral, idéntica a su imagen especular. Las sustancias que tienen centros quirales pero que son en sí mismas aquirales se denominan compuestos meso.
La condición que hace posible la existencia de compuestos meso es un grado apropiado de simetría molecular. Hay varios tipos de tal simetría molecular. En el caso de las fórmulas de proyección\(25\) (o\(26\)) existe un plano de simetría, lo que significa que se puede colocar un plano a través de la molécula de tal manera que una mitad de la molécula sea una imagen especular de la otra mitad. El plano espejo para el ácido meso-tartárico se puede ver fácilmente desde sus fórmulas de proyección\(25b\) y\(26b\). Estas dos fórmulas son superpuestas si se gira una\(180^\text{o}\) en el plano del papel.
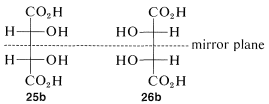
Las representaciones de Newman\(25a\) y\(26a\) del ácido meso-tartárico no tienen plano especular. ¿Por qué es diferente de las proyecciones de Fischer a este respecto? La razón es que las fórmulas de proyección representan una conformación eclipsada particular\(27\) del ácido meso tartárico que sí tiene un plano espejo:
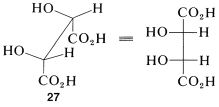
Por lo tanto, si te enfrentes a un corzo o fórmula de Newman en particular y tienes que decidir si representa un compuesto meso, el mejor procedimiento es hacer un modelo de bola y palo de la conformación y luego rotar alrededor de los enlaces para ver si se puede llevar a una conformación ( escalonada o eclipsada) que tenga un plano de simetría (como\(27\)) o sea idéntica a su imagen especular.
Como se esperaba de nuestras discusiones previas, los diastereómeros del ácido tartárico tienen diferentes propiedades físicas (Cuadro 5-2).
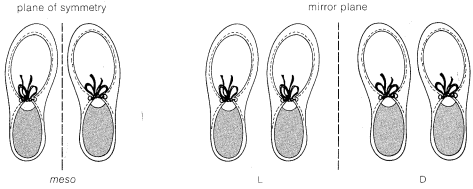
Si te encuentras confundido acerca de las formas\(D,L\) y meso del ácido tartárico, una simple analogía puede ayudar a mantener las cosas claras. Considera tres juegos de zapatos. Un zapato derecho junto a un zapato izquierdo es una combinación meso con un plano de simetría. Un zapato izquierdo al lado de un zapato izquierdo no es idéntico a, pero es

la imagen especular de, un zapato derecho junto a un zapato derecho. Ninguna de las tres combinaciones es idéntica. Cada zapato derecho o izquierdo corresponde a una configuración derecha o izquierda de un carbono de ácido tartárico por lo que los tres conjuntos corresponden al ácido meso\(L\) -, -, y\(D\) -tartárico, respectivamente.
Existe otra prueba de simetría para configuraciones meso que es aplicable a conformaciones escalonadas y se puede ilustrar con los ácidos tartáricos. Si haces modelos de\(25a\) y\(26a\) encontrarás que son imágenes especulares e idénticas pero, como hemos dicho, no tienen plano de simetría. En esta conformación, las moléculas sí tienen un centro de simetría. Así, una línea dibujada en cualquier ángulo a través del punto medio del\(C-C\) enlace central de\(25a\) (o\(26a\)) tiene un ambiente idéntico en cada lado del punto medio. Otra forma de ponerlo es que cada mitad de la molécula es la imagen fotográfica (es decir, inversa) de la otra mitad. Para una molécula con centros quirales, si su fórmula de proyección tiene un plano de simetría o si podemos encontrar una conformación rotacional con un plano o centro de simetría, entonces será meso y aquiral.
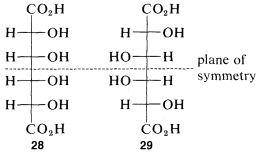
La idea de que por cada centro\(n\) quiral puede haber\(2^n\) diferentes configuraciones será cierta solo si ninguna de las configuraciones tiene simetría suficiente para ser idéntica a su imagen especular. Por cada forma meso habrá un par menos de enantiómeros y un número total menos de configuraciones posibles de lo que teóricamente es posible según el número de centros quirales. A lo sumo, un compuesto meso es posible para estructuras con cuatro centros quirales. Un ejemplo lo ofrecen las formas meso del ácido tetrahidroxihexanodioico que, con cuatro átomos quirales, tienen configuraciones\(28\) y\(29\):
\(^5\)La misma información se puede obtener a partir de fórmulas de proyección. Se puede ver que las proyecciones\(19\) y\(20\) son imágenes especulares y eso\(20\)\(21\),, o no se\(22\) pueden superponer\(19\). Sin embargo, en algunas situaciones la confusión puede resultar en hacer tales comparaciones y es importante poder traducir las fórmulas de proyección en modelos de bola y varilla o dibujos en perspectiva.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


