6.3: Formación de enlaces usando orbitales atómicos
- Page ID
- 73536
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
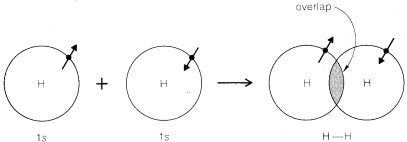
Al escribir las estructuras convencionales de Lewis para moléculas, asumimos que un enlace químico covalente entre dos átomos implica compartir un par de elecciones, una de cada átomo. La Figura 6-5 muestra cómo se puede considerar que los orbitales atómicos se utilizan en la formación de enlaces. Aquí, postulamos que un enlace sencillo se forma por la unión de dos núcleos atómicos por fuerzas atractivas ejercidas por los núcleos para los dos electrones emparejados en orbitales atómicos superpuestos.
Debido a que dos orbitales atómicos pueden contener un máximo de cuatro electrones, es razonable preguntarse por qué es que dos en lugar de uno, tres o cuatro electrones normalmente están involucrados en un enlace. La respuesta es que dos atómicas superpuestas
Se puede considerar que los orbitales se combinan para dar un orbital molecular de enlace de baja energía y un orbital molecular antienlace de alta energía (ver la parte superior de la Figura 6-6 (a)). \(^2\)Se dice que los orbitales que se superponen como se muestra en la Figura 6-6 (a) se superponen a la manera sigma,\(^3\) y el orbital de unión se denomina orbital sigma (\(\sigma\)); el orbital antiadhesión se denomina \(\sigma^*\)orbital (léase “estrella sigma”). Dos electrones apareados bastan para llenar el\(\sigma\) orbital. Cualquier electrón adicional debe entrar en el\(\sigma^*\) orbital de alta energía y contribuir no a la unión sino a la repulsión entre los átomos.
La molécula de hidrógeno ión,\(H_2^\oplus\), puede considerarse como que tiene un electrón en un\(\sigma\) orbital. Se ha estudiado en estado vapor por medios espectroscópicos y se ha encontrado que tiene una energía de disociación a\(H^\oplus\) y\(H \cdot\) de\(61 \: \text{kcal mol}^{-1}\) en comparación con la energía de\(104.2 \: \text{kcal mol}^{-1}\) enlace para\(H_2\). Varias combinaciones posibles de dos orbitales de hidrógeno y de uno a cuatro electrones se muestran en la Figura 6-6 (b).

\(^2\)Más sobre la diferencia entre orbitales ligantes y antiligantes se da en la Sección 21-2. Por ahora diremos que la propiedad de los orbitales que lleva a la unión o antiadhesión es una propiedad análoga a la fase. Una combinación en fase de dos orbitales es la unión, y una combinación fuera de fase es antiadhesión.
\(^3\)La designación sigma (\(\sigma\)) denota que el solapamiento orbital y la densidad de electrones son mayores a lo largo del eje internuclear.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


