6.4: Repulsión de Electrones y Ángulos de Enlace. Hibridación orbital
- Page ID
- 73515
Al predecir ángulos de unión en moléculas pequeñas, encontramos que podemos hacer mucho con la idea simple de que a diferencia de las cargas producen fuerzas atractivas mientras que las cargas similares producen fuerzas repulsivas. Tendremos atracciones electrón-nucleares, repulsiones electrón-electrón, y repulsiones de núcleo-núcleo. Consideremos primero el caso de una molécula con solo dos enlaces de pares de electrones, como cabría esperar que se formara por combinación de berilio e hidrógeno para dar hidruro de berilio,\(H:Be:H\). El problema será cómo formular los vínculos y cómo predecir cuál será el\(H-Be-H\) ángulo\(\theta\),,:
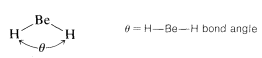
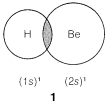
Podríamos formular un segundo\(\sigma\) enlace que involucre el\(2p\) orbital, pero surge un nuevo problema en cuanto a dónde debe ubicarse el hidrógeno en relación con el orbital del berilio. ¿Es como en\(2\)\(3\), o de alguna otra manera?
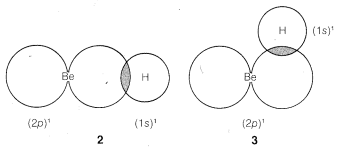
Los\(H\) núcleos\(Be\) y estarán más separados en lo\(2\) que estarán en\(3\) o cualquier otro arreglo similar, por lo que habrá menos repulsión internuclear con\(2\). Por lo tanto, esperamos que el hidrógeno se ubique a lo largo de una línea que atraviesa la mayor extensión de la\(2p\) órbita.
De acuerdo con esta simple imagen, el hidruro de berilio debe tener dos tipos diferentes de\(H-Be\) enlaces, uno como en\(1\) y el otro como en\(2\). Esto es intuitivamente irrazonable para un compuesto tan simple. Además, el ángulo de\(H-Be-H\) unión no está especificado por esta imagen porque el\(2s\)\(Be\) orbital es esféricamente simétrico y podría formar enlaces igualmente bien en cualquier dirección.
No obstante, si nos olvidamos de los orbitales y solo consideramos las posibles repulsiones entre los pares de electrones, y entre los núcleos de hidrógeno, podemos ver que estas repulsiones se minimizarán cuando el ángulo de\(H-Be-H\) enlace sea\(180^\text{o}\). Por lo tanto, la disposición\(5\) debe ser más favorable que\(4\), con un\(H-Be-H\) ángulo menor que\(180^\text{o}\):

Desafortunadamente, no podemos verificar este ángulo de unión en particular por experimento porque\(BeH_2\) es inestable y reacciona consigo mismo para dar un sólido de alto peso molecular. Sin embargo, se sabe que una serie de otros compuestos\(\left( CH_3 \right)_2 Be\)\(BeCl_2\), tales como\(\left( CH_3 \right)_2 Hg\)\(HgF_2\),,\(\left( CH_3 \right)_2 Zn\),, y, tienen\(\sigma\) enlaces que involucran estados de\(\left( s \right)^1 \left( p \right)^1\) valencia. Las mediciones de los ángulos de unión en el metal de estas sustancias en estado de vapor han demostrado que son uniformes\(180^\text{o}\).
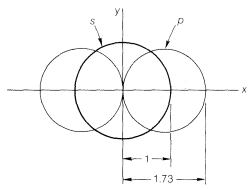
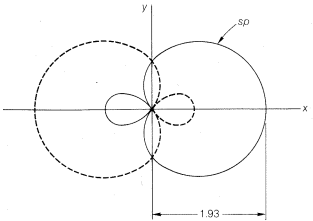
¿Cómo se despliegan\(p\) los orbitales\(s\) y en este tipo de vinculación? Resulta que se forman lazos más fuertes cuando el grado de superposición de los orbitales es alto. El grado de solapamiento dependerá de los tamaños de la órbita y, particularmente, de lo lejos que se extiendan del núcleo. La Figura 6-7 muestra qué tan lejos\(2s\) y\(2p\) orbitales se extienden uno con relación al otro. Vincular con estos orbitales como en\(1\) y\(2\) no utiliza el poder superpuesto de los orbitales en la mayor medida posible. Con\(1\) tenemos solapamiento que utiliza sólo una parte de la\(2s\) órbita, y con\(2\), sólo una parte de la\(2p\) orbital. Moléculas tales como\(BeH_2\) pueden formularse con mejor solapamiento y enlaces equivalentes con la ayuda del concepto de hibridación orbital. Este concepto, publicado independientemente por L. Pauling y J. C. Slater en 1931, implica determinar cuáles (si las hay) combinaciones de\(p\) orbitales\(s\) y pueden superponerse mejor y hacer vínculos más efectivos que el individuo\(s\) y\(p\) los orbitales. El procedimiento matemático para la hibridación orbital predice que un\(s\) y un\(p\) orbital de un átomo pueden formar dos enlaces covalentes más fuertes si se combinan para formar dos nuevos orbitales llamados orbitales\(sp\) hibridados (Figura 6-8). Cada orbital\(sp\) -híbrido tiene una potencia superpuesta de 1.93, en comparación con la\(s\) orbital pura tomada como unidad y una\(p\) orbital pura como 1.73. Los ángulos de enlace de\(180^\text{o}\) se esperan para los enlaces a un átomo usando orbitales\(sp\) híbridos y, por supuesto, este también es el ángulo que esperamos sobre la base de nuestra consideración de las repulsiones mínimas de pares de electrones e internucleares. En adelante, procederemos sobre la base de que moléculas del tipo\(X:M:X\) pueden formar enlaces\(sp\) -híbridos.
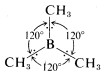
Sobre la base de la repulsión entre pares de electrones y entre núcleos, moléculas como\(BH_3\),\(B \left( CH_3 \right)_3\),\(BF_3\), y\(AlCl_3\), en las que el átomo central forma tres enlaces covalentes utilizando la configuración electrónica de estado de valencia
\(\left( s \right)^1 \left( p_x \right)^1 \left( p_y \right)^1\), se espera que sean planos con ángulos de unión de\(120^\text{o}\). Por ejemplo,
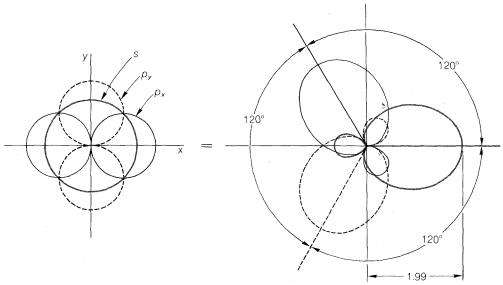
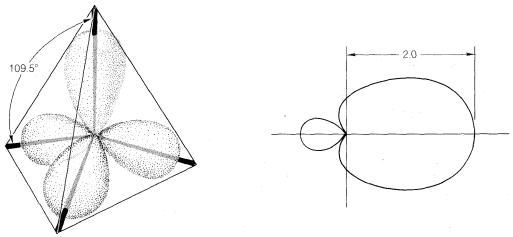
Con átomos como el carbono y el silicio, la configuración electrónica de estado de valencia para formar cuatro enlaces covalentes tiene que ser\(\left( s \right)^1 \left( p_x \right)^1 \left( p_y \right)^1 \left( p_z \right)^1\). La repulsión entre los pares de electrones y entre los núcleos unidos se minimizará mediante la formación de una disposición tetraédrica de los enlaces. La misma geometría se predice a partir de la hibridación uno\(s\) y tres\(p\) orbitales, lo que da cuatro orbitales\(sp^3\) híbridos dirigidos en ángulos entre sí.\(109.5^\text{o}\) La potencia de superposición relativa prevista\(sp^3\) de orbitales híbridos es 2.00 (Figura 6-10).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


