6.5: Modelos atómico-orbitales
- Page ID
- 73523
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Alcanos
Los compuestos saturados como los alcanos y sus derivados, que tienen ángulos tetraédricos normales para los enlaces al carbono, pueden formularse fácilmente en términos de orbitales atómicos con\(sp^3 \: \sigma\) enlaces al carbono. Un ejemplo se muestra en la Figura 6-11, que también muestra cómo se puede dibujar un modelo atómico-orbital en estilo abreviado. Las líneas en este dibujo corresponden a enlaces y se etiquetan como\(sp^3\) con\(sp^3\) (los orbitales superpuestos del\(C-C\) enlace) o como\(sp^3\) con\(s\) (los orbitales superpuestos de los\(C-H\) enlaces).
Átomos con pares de electrones no compartidos
Muchas moléculas importantes como el amoníaco, el agua y el fluoruro de hidrógeno tienen átomos con pares de electrones no compartidos:

Si formulamos cada una de estas moléculas de tal manera que se minimicen las repulsiones entre cargas similares, se esperará una disposición básicamente tetraédrica porque esto colocará los núcleos (y pares de electrones) lo más ampliamente separados posible.

La molécula de agua podría formularse de esta manera\(6\), como en, con el oxígeno en el centro del tetraedro:

El cuadro simple predice que el ángulo de\(H-O-H\) unión debe ser tetraédrico,\(109.5^\text{o}\). Pero en realidad lo es\(104.5^\text{o}\).
Hay dos escuelas de pensamiento en cuanto a por qué es el ángulo\(104.5^\text{o}\). Una idea es que el modelo de repulsión es demasiado simple y tiene que ser modificado para tener en cuenta que la repulsión es más severa entre pares de electrones no compartidos que entre electrones en orbitales enlazantes sobre un mismo átomo. Esto se debe a que cuando se forma un enlace entre dos núcleos, la atracción de los núcleos por los electrones encoge los orbitales disponibles para los electrones de unión, reduciendo así su repulsión electrostática con otros pares. El grado de repulsión entre pares de electrones disminuye en la secuencia: pares no compartidos vs. pares no compartidos pares\(>\) no compartidos vs. pares de unión pares de\(>\) unión vs. pares de unión. De esto, esperamos que en el agua el\(H-O-H\) ángulo sea menor que tetraédrico, debido a que la mayor repulsión entre los dos pares no compartidos tenderá a empujar los pares de unión más cerca entre sí.

Se espera un efecto similar, pero menor, para el amoníaco porque ahora la repulsión es solo entre el par no compartido y los pares de unión. El\(H-N-H\) ángulo de amoníaco es\(107.3^\text{o}\), que es sólo ligeramente menor que el valor tetraédrico de\(109.5^\text{o}\).
El punto de vista alternativo de por qué es el ángulo de unión del agua\(104.5^\text{o}\) comienza con la premisa de que, en la aproximación más simple, ¡el ángulo debería ser\(90^\text{o}\)! Para ver cómo se produce esto comparemos\(H:Be:H\) con\(H:\underset{\cdot \cdot}{\ddot{O}}:H\). Recordarán que para formar dos enlaces a\(Be\), tuvimos que promover un electrón y cambiar la configuración electrónica a la configuración de valencia,\(\left( 2s \right)^1 \left( 2p \right)^1\). La situación con\(H_2O\) es diferente en que el estado fundamental del oxígeno y el estado de valencia son los mismos,\(\left( 2s \right)^2 \left( 2p_x \right)^1 \left( 2p_y \right)^1 \left( 2p_z \right)^1\). Esto significa que podríamos formar dos enlaces equivalentes al oxígeno usando los\(2p_z\) orbitales\(2p_y\) y en un ángulo de\(90^\text{o}\) (Figura 6-12).

Ahora bien, para explicar por qué los ángulos de\(H-O-H\) enlace son\(104.5^\text{o}\) en lugar de\(90^\text{o}\), podemos decir que se espera que la repulsión entre los núcleos de hidrógeno ensanche el ángulo de enlace. Un argumento a favor de esta formulación es proporcionado por el ángulo de unión en\(H_2S\), que es\(92.2^\text{o}\). Esto está mucho más cerca de los orbitales\(90^\text{o}\)\(p\) esperados para enlaces y no se\(H_2S\) esperaría que los hidrógenos en se repelan entre sí tanto como en\(H_2O\) porque el azufre es un átomo más grande que el oxígeno.
Ambas formas de formular los orbitales utilizados en la unión de moléculas de agua están en uso actual. Se pueden presentar argumentos a favor de ambos. Cálculos cuantitomecánicos altamente sofisticados, de los que diremos más adelante, sugieren que el oxígeno en las moléculas de agua utiliza orbitales que están\(18\% \: s\) y\(82\% \: p\) en sus enlaces (\(sp^{4.5}\)), y además, que los pares no compartidos están en orbitales híbridos equivalentes [no un par como\(\left( 2s \right)^2\) y el otro como\(\left( 2p \right)^2\)]. Cada uno de los orbitales de pares de electrones no compartidos de oxígeno en el agua se calcula en aproximadamente\(40\% \: s\) y\(60\% \: p\) (\(sp^{1.5}\)).
Los resultados apenas son claros, pero los orbitales de unión están considerablemente más cerca de\(sp^3\) (\(25\% \: s\)y\(75\% \: p\)) de lo que están\(100\% \: p\). Recomendamos que se consideren los orbitales de unión de nitrógeno y oxígeno\(sp^3\) y que los pares no compartidos se designen simplemente como\(\left( n \right)^2\). En la Figura 6-13 se muestra un modelo orbital atómico abreviado de metanol\(CH_3OH\), hecho sobre esta base.
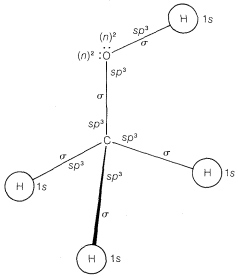
Compuestos con Doble Enlace
Recordemos del Capítulo 2 que los ángulos de enlace en compuestos con dobles enlaces carbono-carbono como el eteno están más cerca\(120^\text{o}\) que al valor tetraédrico normal de\(109.5^\text{o}\). Hay varias formas en las que un doble enlace carbono-carbono puede formularse en términos de modelos atómico-orbitales. Un enfoque muy popular es considerar que el eteno tiene dos carbonos\(sp^2\) hibridados que forman un\(\sigma\) enlace carbono-carbono y cuatro\(\sigma\) enlaces carbono-hidrógeno por superposición de los seis\(sp^2\) orbitales, como se muestra en la Figura 6-14. El enlace carbono-carbono restante se formula como resultado del solapamiento lateral de los dos\(p\) orbitales, uno en cada carbono, que no se utilizan en la fabricación de los\(sp^2\) híbridos. El solapamiento lateral de\(p\) orbitales se denomina \(\pi\)solapamiento para distinguirlo del \(\sigma\)solapamiento final del tipo que hemos discutido anteriormente (Figura 6-15). El \(\pi\)enlace resultante difiere del \(\sigma\)enlace en que la densidad electrónica se concentra en las regiones por encima y por debajo del eje del enlace en lugar de a lo largo del eje del enlace.
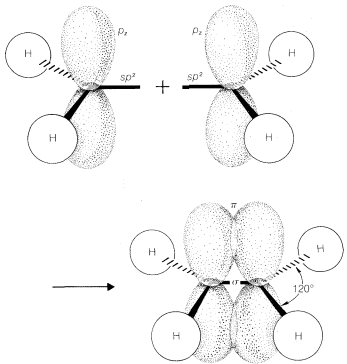
Las formulaciones de eteno de esta manera sugieren que debe ser una molécula plana con\(H-C-H\) ángulos de\(120^\text{o}\). El eteno es de hecho plano, pero se encuentra que sus\(H-C-H\) ángulos son\(117^\text{o}\), en lugar de los\(120^\text{o}\) predichos para\(sp^2\) los enlaces. Una explicación de esta discrepancia utilizando más argumentos de repulsión de electrones se discutirá más adelante en el capítulo.

La simple elegancia del\(\sigma\) -\(\pi\) modelo de eteno no debe tomarse como prueba de que en realidad existen dos tipos diferentes de enlaces entre los carbonos. La\(\sigma\) -\(\pi\) representación de los dobles enlaces no es realmente única. Dada la\(sp^2\) hibridación de los carbonos por lo que hay\(sp^2\) -\(\sigma\) enlaces a los hidrógenos, es posible tomar los\(p\) orbitales\(sp^2\) y utilizados para los\(\pi\) enlaces\(\sigma\) y, rehibridarlos, y así derivar un nuevo conjunto de orbitales superpuestos para el doble enlace. Estos orbitales se denominan orbitales de unión\(\tau\) (tau) y pueden ser representados por dos orbitales en forma de plátano entre los carbonos (Figura 6-16). El resultado son dos\(C-C\) bonos completamente equivalentes. El\(\tau\) modelo tiene la ventaja de ofrecer un llamativo paralelo a los modelos de bola y palo, mientras que el\(\pi\) modelo\(\sigma\) - es de particular valor como base para cálculos cuantitativos, como se discutirá en el Capítulo 21.

Utilizando el\(\pi\) modelo\(\sigma\) - de dobles enlaces, concluimos que la configuración retorcida mostrada en la Figura 6-17 no debe ser muy estable. Aquí los\(p\) orbitales no están en posición de superponerse efectivamente en la\(\pi\) manera. Se espera que la configuración favorecida tenga los ejes de los\(p\) -\(\pi\) orbitales paralelos. Debido a que se tendría que gastar una energía considerable para romper el\(p\)\(\pi\) doble enlace y permitir la rotación alrededor del\(\sigma\) enlace restante\(sp^2\), se espera una rotación restringida e isómeros cis-trans estables. Conclusiones similares se pueden llegar a partir del\(\tau\) modelo del doble enlace.

Compuestos con Triple Enlace
Ethyne\(C_2H_2\),, es un compuesto orgánico que suele formularse con enlaces\(sp\) híbridos. La estructura carbono-hidrógeno se construye a través del\(\sigma\) solapamiento de dos orbitales\(sp\) híbridos, uno de cada átomo de carbono, para formar un\(C-C\) enlace, y la\(\sigma\) superposición de los\(sp\) orbitales restantes con el\(s\) orbital de dos hidrógenos para formar\(C-H\) enlaces. Los dos enlaces carbono-carbono restantes resultan a través del\(\pi\) solapamiento lateral de los\(p\) orbitales puros, como se muestra en la Figura 6-18. Este modelo encaja bien con las propiedades de la molécula de etino siendo lineales (ángulos de enlace de\(180^\text{o}\). Además, los\(C-H\) enlaces en el etino son diferentes de los del eteno o etano, según se juzga por sus frecuencias de\(C-H\) estiramiento y flexión en el

infrarrojo (Capítulo 9), sus energías de enlace, (Cuadro 4-6), y sus acidedades (Sección 11-8). Estas diferencias en las propiedades concuerdan con los diferentes estados de hibridación de los orbitales de carbono que hemos postulado para etano, eteno y etino.
Más sobre Orbitales de Enlace Híbrido y Geometría Molecular
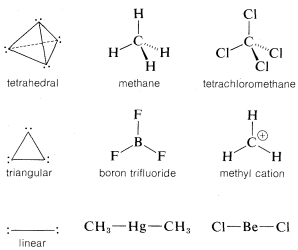
En el Cuadro 6-2 se presenta un resumen del\(s\) carácter direccional de los orbitales atómicos\(p\) híbridos discutidos hasta ahora. Al hacer referencia a esta tabla, suele ser posible deducir la naturaleza de los orbitales de unión para la mayoría de los compuestos orgánicos a partir de la geometría molecular, si esto se conoce, así una molécula tetraédrica\(AX_4\) con cuatro ligandos unidos utiliza orbitales\(sp^3\) híbridos localizados en el átomo\(A\); un plano molécula triangular\(AX_3\) con tres ligandos unidos en ángulos de\(120^\text{o}\) se\(sp^2\) hibrida en el átomo\(A\); una molécula lineal\(AX_2\) con dos ligandos se\(sp\) hibrida en\(A\).

Aplicando lo contrario de estas reglas, uno debería ser capaz de predecir la geometría molecular haciendo suposiciones razonables sobre el estado de hibridación para cada átomo en la molécula. Obviamente al hacer esto hay que tener en cuenta los pares de electrones no compartidos. La predicción es fácil si los pares no compartidos están ausentes. Así, cuatro ligandos unidos, como en\(CH_4\), o\(CCl_4\)\(BF_4^\ominus\), implican\(sp^3\) hibridación en el átomo central y por lo tanto una disposición tetraédrica de ligandos. Tres ligandos, unidos al carbono en\(CH_3^\oplus\) o al boro en\(BF_3\), implican\(sp^2\) hibridación para el átomo central y una disposición triangular plana si ligandos. Dos ligandos, como en\(CO_2\), implican\(sp\) hibridación y geometría lineal.
En muchas de nuestras discusiones posteriores sobre reacciones orgánicas, nos ocuparemos de las especies de carbono catiónicas, radicales y aniónicas que son productos de sustitución de\(CH_3^\oplus\),\(CH_3 \cdot\), y\(CH_3:^\ominus\). Por la importancia de estas entidades, se debe saber formularlas y sustancias afines, como\(^\ominus: \ddot{N}H_2\), con orbitales atómicos. Quizás la forma más directa es partir\(CH_4\) y ver qué cambios en los\(C-H\) vínculos esperaríamos como resultado de los procesos hipotéticos:\(CH_4 \rightarrow CH_3:^\ominus + H^\oplus\),\(CH_4 \rightarrow CH_3^\oplus + H:^\ominus\), y\(CH_4 \rightarrow CH_3 \cdot + H \cdot\).
El metano es tetraédrico con orbitales de enlace de\(sp^3\) carbono. Eliminación de\(H^\oplus\)\(CH_3:^\ominus\) daos, que corresponde en estructura electrónica a\(H_3N:\) y, por las mismas razones, debe tener una forma piramidal con\(H-C-H\) ángulos casi tetraédricos. Eliminación de\(H:^\ominus\) de\(CH_4\) para dar\(CH_3^\oplus\) con seis electrones de unión, sugiere un cambio en los orbitales de\(sp^2\) unión para el carbono y geometría plana con\(H-C-H\) ángulos de\(120^\text{o}\).

El radical,\(CH_3 \cdot\) presenta un problema especial. Podemos pensar que se forma por la pérdida de\(CH_4\), por la adición\(H \cdot\) de un electrón a plano\(CH_3^\oplus\), o por la eliminación de un electrón de piramidal\(CH_3:^\ominus\). Podemos formular\(CH_3 \cdot\) con\(Sp^2\) orbitales para los\(C-H\) enlaces y el electrón extra en un\(p\) orbital, o con\(sp^3\) orbitales para los\(C-H\) enlaces y el electrón extra en un\(sp^3\) orbital:

La estructura real de\(CH_3 \cdot\) tiene los hidrógenos y carbonos en un plano (izquierda). Por lo tanto, parece que las repulsiones entre los pares de electrones de enlace son mayores que las repulsiones entre el electrón extra y los pares de enlace. La estructura real corresponde a aquella en la que los pares de unión están lo más separados posible.
Más sobre Repulsión Interelectrónica y Ángulos de Enlace
Las moléculas del tipo\(AX_4\), que tienen cuatro ligandos idénticos en el átomo central y no hay electrones no compartidos en\(A\) (por ejemplo,\(CH_4\) y\(CCl_4\)), se espera que sean, y sean, tetraédricas. Por el mismo razonamiento, tres pares de electrones alrededor de un átomo deben buscar una disposición plana con\(120^\text{o}\) ángulos para minimizar la repulsión de electrones; en consecuencia, las especies del tipo\(AX_3\), que no tienen pares no compartidos en\(A\) (e.g.,\(BF_3\) y\(CH_3^\oplus\)), tienen esta geometría. Con solo dos pares de electrones, la disposición preferida es lineal.
Los ángulos de enlace de los compuestos con enlaces múltiples pueden explicarse de manera similar. Por ejemplo, en eteno los cuatro electrones del doble enlace ocupan la región en el espacio entre los dos núcleos de carbono. La situación en cualquiera de los dos carbonos es más bien como el\(AX_3\) caso, excepto que uno de los ligandos ahora tiene un doble complemento de electrones de unión:

Por lo tanto, se espera que los orbitales de carbono se dirijan en un plano para dar ángulos de enlace que se desvían algo\(120^\text{o}\) debido a la alta densidad de electrones en el enlace múltiple. Así el\(H-C-H\) ángulo se contrae a\(117^\text{o}\), mientras que los\(H-C=C\) ángulos se abren hasta\(122^\text{o}\), porque la repulsión entre electrones en los\(H-C=C\) enlaces es mayor que entre electrones en los\(H-C-H\) enlaces.
El poder de atracción de electrones (o electronegatividad) de los ligandos también es importante para determinar los ángulos de enlace. Así, para compuestos del tipo\(CH_3X\), en el que\(X\) es un grupo más atrayente de electrones que el carbono, el\(C-X\) enlace se polariza en el sentido\(H_3 \overset{\delta \oplus}{C} - - - \overset{\delta \ominus}{X}\), y el carbono entonces debería tener algo del carácter de\(CH_3^\oplus\). Así se espera que los\(H-C-H\) ángulos sean mayores que\(109.5^\text{o}\), como de hecho lo son. En el clorometano, por ejemplo, el\(H-C-H\) ángulo es\(111^\text{o}\).
También, podemos explicar sobre la base de las repulsiones de electrones por qué el ángulo de enlace en la fosfina,\(:PH_3\) (\(93^\text{o}\)), es menor que el del amoníaco,\(:NH_3\) (\(107.3^\text{o}\)), y el ángulo de enlace en\(H: \underset{\cdot \cdot}{\ddot{S}} :H\) (\(92.2^\text{o}\)) es menor que el de\(H: \underset{\cdot \cdot}{\ddot{O}}\) (\(104.5^\text{o}\)). El punto importante es que el fósforo y el azufre son átomos más grandes que el nitrógeno y el oxígeno. Esto significa que los ángulos de\(H-P-H\) unión\(H-S-H\) y pueden ser aproximadamente\(90^\text{o}\) sin acercar los hidrógenos y los pares de unión tan cerca como están\(H_2O\) y\(NH_3\) donde los ángulos de unión están cerca del valor tetraédrico.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


