9.12: Espectroscopia de Masas
- Page ID
- 72854
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
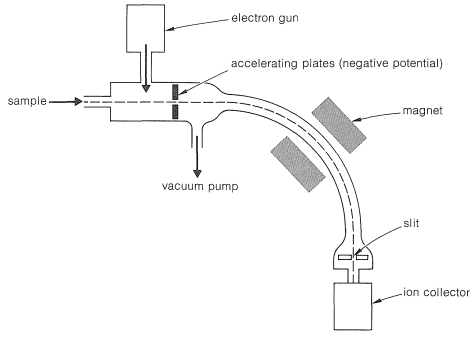
La aplicación habitual de la espectroscopia de masas a moléculas orgánicas implica el bombardeo con un haz de electrones de energía media (\(50\)-\(100 \: \text{eV}\) o\(1150\) -\(2300 \: \text{kcal mol}^{-1}\)) en alto vacío, y el análisis de las partículas cargadas y fragmentos así producidos. La mayoría de los espectrómetros de masas se configuran para analizar fragmentos cargados positivamente, aunque también es posible la espectrometría de masas de iones negativos. Los elementos de un espectrómetro de masas se muestran en la Figura 9-51. Los iones positivos producidos por el impacto de electrones son acelerados por las placas aceleradoras cargadas negativamente y barren hacia abajo hasta la curva del tubo analizador donde se clasifican en cuanto a su masa a carga (\(\left( m/e \right)\)relación por el imán de análisis. Con buena resolución, solo los iones de un solo número de masa pasarán por la hendidura e incidirán en el colector, incluso cuando los números de masa estén en el vecindario de varios miles. Las poblaciones de todo el rango de números de masa de interés se pueden determinar graficando la tasa de recolección de iones en función del campo magnético del imán de análisis.
Los espectros de masas de 2-propanona, 2-butanona y propanal se muestran en la Figura 9-52. Cada pico representa iones de masas particulares formadas como resultado de la fragmentación de la molécula producida por el impacto de electrones en\(\ce{CH_3^+}\),\(\ce{CH_3CH_2^+}\),\(\ce{CH_3CO}^\oplus\), y así sucesivamente. Los “patrones de craqueo” son, por supuesto, funciones de la energía de los electrones bombardeadores y sirven como una huella extraordinariamente individual de las moléculas particulares. Por ejemplo, la 2-propanona y el propanal son isómeros, pero sus patrones de craqueo son sorprendentemente diferentes.

El pico que es más alto en número de masa es de considerable importancia porque corresponde a la molécula parental\(M\) menos un electrón (designado como\(M^+\)) y proporciona un método altamente preciso para medir pesos moleculares. Se obtendrán pesos moleculares incorrectos si el ion positivo,\(M^+\), se fragmenta antes de que llegue al colector, o si dos fragmentos se combinan para dar un fragmento más pesado que\(M^+\). El pico de\(M^+\) es especialmente débil con alcoholes e hidrocarburos de cadena ramificada, que experimentan fácilmente fragmentación por pérdida de agua o grupos de cadena lateral. Con tales compuestos el pico correspondiente a\(M^+\) puede ser\(0.1\%\) o menos del pico más alto del espectro, que se denomina pico base y generalmente se le asigna una intensidad arbitraria de 100.
La presión de la muestra en la fuente de iones de un espectrómetro de masas suele ser de aproximadamente\(10^{-5} \: \text{mm}\), y, en estas condiciones, la acumulación de fragmentos para dar picos significativos con\(m/e\) mayores de lo que\(M^+\) es raro. Una excepción a esto es la formación de\(\left( M + 1 \right)^+\) picos resultantes de la transferencia de un átomo de hidrógeno de\(M\) a\(M^+\). Las intensidades relativas de dichos\(\left( M + 1 \right)^+\) picos suelen ser sensibles a la presión de la muestra y pueden identificarse de esta manera.
Con el peso molecular disponible desde el\(M^+\) pico con certeza razonable, el siguiente paso es determinar la fórmula molecular. Si la resolución del instrumento es suficientemente alta, se pueden medir masas bastante exactas, lo que significa que se pueden distinguir iones con\(m/e\) valores que difieren en una parte en 50,000. A esta resolución es posible determinar la composición elemental de cada ion a partir de su\(m/e\) valor exacto.
Muchos espectrómetros de masas en uso rutinario son incapaces de resolver iones con\(m/e\) valores que difieren en menos de una unidad de masa. En este caso, la determinación de la composición elemental se puede determinar por el método de abundancia de isótopos. Ilustraremos esto con el siguiente ejemplo sencillo.
Los picos más altos correspondientes\(M^+\) en el espectro de masas de una muestra desconocida tienen\(m/e\) igual a 64 y 66 con intensidades relativas de 3:1. ¿Cuál es la composición elemental? La relación de abundancia 3:1 es singularmente característica de los isótopos de cloro,\(\ce{^{35}Cl}\):\(\ce{^{37}Cl} =\) 3:1. Los picos de masa a 64 y 66 son, por lo tanto, ambos iones moleculares; el pico 64 es de un ion que contiene\(\ce{^{35}Cl}\) y el pico 66 es de un ion que contiene\(\ce{^{37}Cl}\). Los átomos restantes en la molécula deben sumar hasta\(\left( 64 - 35 \right) = 29\), o unidades de\(\left( 66 - 37 \right) = 29\) masa. Hay varias combinaciones posibles de\(\ce{C}\),\(\ce{H}\),\(\ce{N}\), y\(\ce{O}\) que dan masa 29; son\(\ce{N_2H}\)\(\ce{CHO}\),\(\ce{CH_3N}\), y\(\ce{C_2H_5}\). \(^{15}\)De estos, la combinación con\(\ce{Cl}\) eso tiene más sentido químico es\(\ce{C_2H_5}\), y la fórmula de la molécula por lo tanto es\(\ce{C_2H_5Cl}\), cloroetano.
Este ejemplo ilustra cómo se pueden usar\(m/e\) valores de iones que difieren solo en la composición isotópica para determinar las composiciones elementales. Los isótopos importantes para este propósito además de los del cloro son los isótopos estables de abundancia natural.\(\ce{^{13}C}\)\(\left( 1.1\% \right)\),\(\ce{^{15}N}\)\(\left( 0.37\% \right)\),\(\ce{^{17}O}\)\(\left( 0.04\% \right)\), y\(\ce{^{18}O}\)\(\left( 0.20\% \right)\). Como ejemplo adicional, supongamos que hemos aislado un hidrocarburo y hemos determinado a partir de su espectro de masas que\(M^+ =\) 86 unidades de masa. En ausencia de cualquier reacción de combinación habrá un\(\left( M + 1 \right)^+\) ion correspondiente al mismo ion molecular pero con un\(\ce{^{13}C}\) ion en lugar de\(\ce{^{12}C}\). La relación de intensidad\(\left( M + 1 \right)^+/M^+\) dependerá del número de átomos de carbono presentes, debido a que cuantos más carbonos haya, mayor será la probabilidad de que uno de ellos esté\(\ce{^{13}C}\). Cuanto mayor sea la probabilidad, mayor será la\(\left( M + 1 \right)^+/M^+\) relación. Para\(n\) los carbonos, esperamos
\[\frac{\text{abundance of} \left( M + 1 \right)^+}{\text{abundance of} \: M^+} = n \times \% \ce{^{13}C} \: \text{abundance}/100\]
Si la\(\left( M + 1 \right)^+/M^+\) relación medida es 6. 6:100, entonces
\[\begin{align} \frac{6.6}{100} &= n \times 1.1/100 \\ n &= 6 \end{align}\]
La única fórmula hidrocarbonada con\(M^+ =\) 86 y\(n=6\) es\(\ce{C_6H_{14}}\).
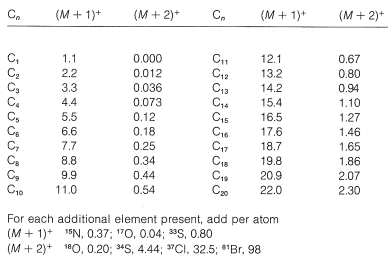
Nitrógeno\(as \(\ce{^{15}N}\)) y oxígeno (as\(\ce{^{17}O}\)) también contribuyen a\(\left( M + 1 \right)^+\), si están presentes, mientras que\(\ce{^{18}O}\) y dos\(\ce{^{13}C}\) contribuyen a\(\left( M + 2 \right)^+\). Las intensidades calculadas de\(\left( M + 1 \right)^+\) y\(\left( M + 2 \right)^+\) relativas a\(M^+\) (como 100) se tabulan en la Tabla 9-5 para la composición elemental de iones hasta\(\ce{C_{20}}\). La tabla se aplica tanto a los iones fragmentados como a los iones moleculares, pero los datos de intensidad de los iones fragmentos a menudo se complican por picos superpuestos.
Cuadro 9-5: Contribuciones isotópicas para carbono y otros elementos a intensidades de\(\left( M + 1 \right)^+\) y\(\left( M + 2 \right)^+\) relativas a\(M^+\) (100)
El siguiente paso en el análisis de un espectro de masas es ver qué pistas en cuanto a la estructura se pueden obtener a partir de los iones fragmentos. Sería un grave error imaginar que en los espectros de masas no se observa nada más que una simple fragmentación inespecífica de moléculas orgánicas sobre el impacto electrónico. En realidad, aunque el impacto electrónico produce iones moleculares altamente inestables, existe una fuerte tendencia a que se produzca la descomposición por procesos químicos razonables, y esto puede implicar una fragmentación directa o reordenamiento de átomos de una parte de la molécula a otra.
En general, la fragmentación ocurre en los enlaces más débiles, y los fragmentos más abundantes también son los más estables. Por ejemplo, los hidrocarburos se fragmentan preferentemente en puntos de ramificación, en parte porque los\(\ce{C-C}\) enlaces son más débiles aquí que en otros lugares a lo largo de la cadena, y en parte porque los fragmentos iónicos son más estables. Como ejemplo, considere el 2,2-dimetilbutano. No hay iones moleculares evidentes en su espectro de masas porque se escinde tan fácilmente en el carbono cuaternario para dar el pico\(m/e\) 57 correspondiente al ion fragmento más abundante. Este ion es presumiblemente el catión terc- butilo y la escisión alternativa al catión etilo menos estable con\(m/e =\) 29 es mucho menos significativa.

Un excelente ejemplo de un reordenamiento con fragmentación lo proporciona el\(M^+\) ion de butanoato de etilo, que se descompone para dar eteno y el\(M^+\) ion de un isómero de etanoato de etilo llamado su “forma enol”.

Un reordenamiento interesante y complejo ocurre en el impacto de electrones con metilbenceno (tolueno). Se observa un pico intenso teniendo\(m/e\) for\(\ce{C_7H_7^+}\), pero el ion involucrado parece ser un\(\ce{C_7H_7^+}\) ion simétrico, en lugar de un catión fenilmetilo. La evidencia para ello es que los patrones de fragmentación encontrados en la espectrometría de masas del ion en sí son los mismos, sin importar cuál de los monodeuteriometilbencenos se utilice como material de partida. Este reordenamiento ocurre debido a la alta energía de deslocalización del\(ce{C_7H_7}^\oplus\) ion simétrico (generalmente llamado “catión tropilio”) y porque su carga se extiende más uniformemente sobre los carbonos de lo que sería la carga para el catión fenilmetilo (ver Sección 8-7B).

\(^{15}\)Las tabulaciones de composiciones elementales de\(\ce{C}\)\(\ce{H}\),\(\ce{N}\) y\(\ce{O}\) para valores de masa de hasta 250 se enumeran en muchos textos sobre espectrometría de masas. Consulta estas tablas para ver todas las alternativas posibles. Véase también J. H. Beynon, Espectrometría de masas y sus aplicaciones a la química orgánica, Elsevier Publishing Co., Ámsterdam, 1960.
Referencias
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


