11.6: Adición de Hidruros de Boro a Alquenos. Organoboranes
- Page ID
- 73638
Un grupo especialmente valioso de intermedios se puede preparar mediante la adición de un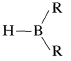 compuesto a dobles o triples enlaces carbono-carbono:
compuesto a dobles o triples enlaces carbono-carbono:

La reacción se llama hidroboración y es una síntesis versátil de compuestos organoborónicos. Un ejemplo es la adición de diborano,\(\ce{B_2H_6}\), al eteno. Diborane se comporta como si estuviera en equilibrio con\(\ce{BH_3}\)\(\left( \ce{B_2H_6} \rightleftharpoons 2 \ce{BH_3} \right)\), y la adición procede en tres etapas:
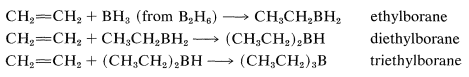
El monoalquilborano\(\ce{RBH_2}\), y el dialquilborano\(\ce{R_2BH}\), rara vez se aíslan porque se agregan rápidamente al alqueno. Estas adiciones equivalen a la reducción de ambos carbonos del doble enlace:
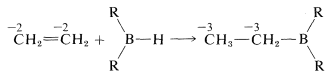
Los organoboranos pueden considerarse compuestos organometálicos. El boro elemental no tiene las propiedades de un metal, y los enlaces boro-carbono son más covalentes que iónicos. Sin embargo, el boro es más electropositivo que el carbono o el hidrógeno y cuando se une al carbono se comporta como la mayoría de los metales en el sentido de que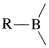 los enlaces están polarizados con\(\ce{R}\) negativo y boro positivo:
los enlaces están polarizados con\(\ce{R}\) negativo y boro positivo:
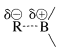
La hidroboración y los múltiples usos de los organoboranos en la síntesis fueron desarrollados en gran parte por H. C. Brown y sus compañeros de trabajo. En nuestra discusión, daremos más detalles sobre la hidroboración misma, para luego describir varias transformaciones útiles de organoboranos.
Hidroboración
El borano más simple\(\ce{BH_3}\),, existe como el dímero,\(\ce{B_2H_6}\), o en forma complejada con ciertos éteres o sulfuros:
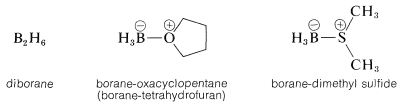
Cualquiera de estos\(\ce{BH_3}\) compuestos se añade fácilmente a la mayoría de los alquenos a temperatura ambiente o temperaturas más bajas. Las reacciones generalmente se llevan a cabo en disolventes éter, aunque los disolventes hidrocarbonados se pueden usar con el complejo borano-sulfuro de dimetilo. Cuando el reactivo es diborano, se puede generar in situ o externamente a través de la reacción de trifluoruro de boro con borohidruro de sodio:
\[3 \overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{B}} \ce{H_4} + 4 \ce{BF_3} \rightarrow 2 \ce{B_2H_6} + 3 \overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{B}} \ce{F_4}\]
Las hidroboraciones tienen que realizarse con cierto cuidado, porque el diborano y muchos alquilboranos son sustancias altamente reactivas y tóxicas; muchas son espontáneamente inflamables en el aire.
Con alquenos asimétricos, la hidroboración ocurre de manera que el boro se une al extremo menos sustituido del doble enlace:

Estas adiciones son adiciones suprafaciales:
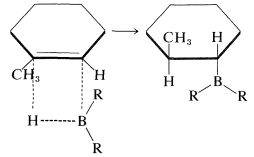
Además, cuando hay una opción, la adición ocurre preferentemente desde el lado menos abarrotado del doble enlace:

Si el alqueno es una molécula voluminosa, el borano puede añadir solo una o dos moléculas de alqueno para dar mono- o dialquilborano,\(\ce{RBH_2}\) o\(\ce{R_2BH}\), respectivamente, como muestran las siguientes reacciones:

Estos boranos voluminosos todavía poseen\(\ce{B-H}\) enlaces y pueden agregarse más a un enlace múltiple, pero son reactivos altamente selectivos y se agregan solo si el alqueno o alquino no está obstaculizado. Esta selectividad puede ser útil, particularmente para 1-alquinos, que son difíciles de detener en la etapa de alquenilborano cuando se usa diborano:
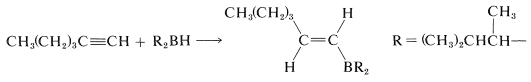
Con un dialquilborano voluminoso, como el di- (1,2-dimetilpropil) borano, no se produce una adición adicional al alquenilborano.
Se prepara un reactivo hidroborante especialmente selectivo a partir de 1,5-ciclooctadieno y borano. El producto es un compuesto bicíclico de estructura\(1\) (a menudo abreviado como 9-BBN), en el que el\(\ce{B-H}\) enlace residual se suma a alquenos sin impedimentos con una selectividad mucho mayor que la observada con otros reactivos hidroborantes. También es uno de los pocos boranos que reacciona suficientemente lentamente con el oxígeno para que pueda ser manipulado en el aire.
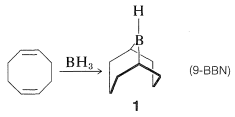
Un ejemplo de la diferencia de selectividad en la hidroboración de cis-4-metil-2-penteno con\(\ce{B_2H_6}\) y\(1\) sigue:

Mecanismo de Hidroboración
De acuerdo con la tabla de electronegatividad (Figura 10-11), el enlace boro-hidrógeno se polariza en el sentido\(\overset{\delta \oplus}{\ce{B}} --- \overset{\delta \ominus}{\ce{H}}\). Por lo tanto, la dirección de adición de\(\ce{B_2H_6}\) propeno es la esperada de un mecanismo polar mediante el cual el átomo de boro electrófilo se une al carbono menos sustituido del doble enlace.
Mecanismo paso a paso
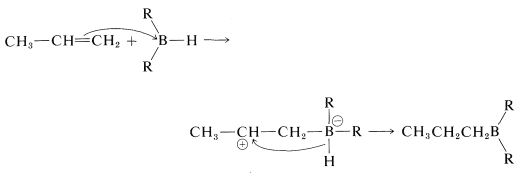
Sin embargo, no hay evidencia firme que sugiera que se forme un intermedio de carbocatión a través de una reacción de adición electrófila escalonada. Por esta razón, la reacción a menudo se considera una adición concertada de cuatro centros.
Mecanismo concertado
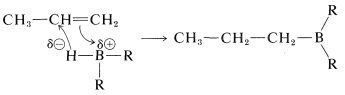
La formulación paso a paso explica por qué el boro se adhiere al carbono menos sustituido, pero no explica el hecho de que las reacciones no muestran otras características de las reacciones de carbocatión. Esto podría deberse a una tasa esperada, extraordinariamente rápida de transferencia de iones hidruro al carbocatión. Una objeción más seria al mecanismo paso a paso es que los alquinos reaccionan más rápidamente que los alquenos, algo que normalmente no se observa para adiciones electrofílicas escalonadas (ver sección 10-5).
Isomerización de alquilboranos
Algunos alquilboranos se reordenan\(\left( 160^\text{o} \right)\) a temperaturas elevadas para formar isómeros más estables. Por ejemplo, el alquilborano\(2\), producido por hidroboración de 3-etil-2-penteno, se\(3\) reorganiza al calentar:
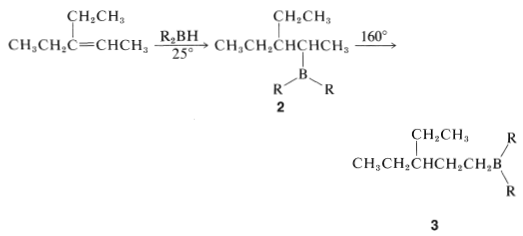
En general, el boro en alquilboranos prefiere estar al final de una cadena hidrocarbonada por lo que está unido a un carbono primario donde el hacinamiento estérico alrededor del boro es menos severo. Por lo tanto, el reordenamiento tiende a proceder en la dirección
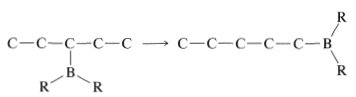
El reordenamiento se asocia con el hecho de que la hidroboración es reversible a temperaturas elevadas. Esto hace posible una secuencia de reacciones de eliminación-adición en las que el boro se une a diferentes carbonos y finalmente conduce al producto más estable que tiene boro unido al carbono al final de la cadena:
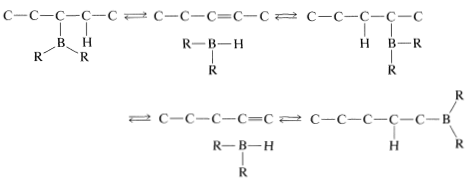
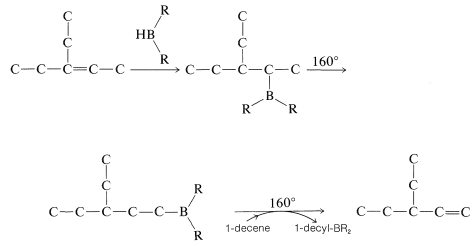
El reordenamiento de alquilboranos se puede utilizar para transformar alquenos con dobles enlaces en el centro de la cadena en 1-alquenos menos estables; por ejemplo,\(\ce{RCH=CHCH_3} \rightarrow \ce{RCH_2-CH=CH_2}\). El procedimiento implica la hidroboración del alqueno de partida de la manera habitual; luego el borano se isomeriza por calentamiento. Luego se agrega un exceso de 1-deceno (pb\(170^\text{o}\)) al borano reordenado y la mezcla se recalienta. El calentamiento hace que el alquilborano se disocie en 1-alqueno y\(\ce{HBR_2}\); el 1-deceno “elimina” el a\(\ce{HBR_2}\) medida que se forma, permitiendo así que un 1-alqueno (pb\(<170^\text{o}\)) más volátil se elimine por destilación simple. Así, para el reordenamiento de 3-etil-2-penteno a 3-etil-1-penteno,
Reacciones Sintéticas de Organoboranos
Los alquilboranos formados en la hidroboración de alquenos y alquinos rara vez se aíslan; en su mayor parte se utilizan como intermedios reactivos para la síntesis de otras sustancias. En las reacciones de los alquilboranos, el\(\ce{B-C}\) enlace se escinde en el sentido de\(\ce{B}^\oplus - \ce{C}^\ominus\) manera que el carbono se transfiere a otros átomos, tales como\(\ce{H}\),,\(\ce{O}\)\(\ce{N}\), y\(\ce{C}\), con su par de electrones de enlace:
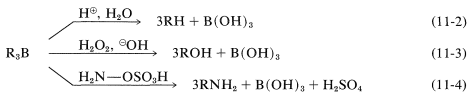
En la primera de estas reacciones (Ecuación 11-2), se produce un hidrocarburo por la escisión de un borano,\(\ce{R_3B}\), con ácido acuoso, o mejor, con ácido propanoico anhidro,\(\ce{CH_3CH_2CO_2H}\). La secuencia global de hidrólisis hidroboración-ácido logra la reducción de un enlace múltiple carbono-carbono sin usar hidrógeno y un catalizador metálico o diimida (Tabla 11-3):
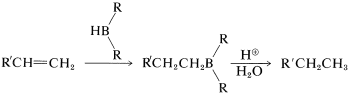
Tabla 11-3: Algunos métodos de hidrogenación de enlaces múltiples carbono-carbono
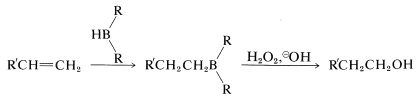
La segunda reacción (Ecuación 11-3) logra la síntesis de un alcohol primario mediante la oxidación del alquilborano con peróxido de hidrógeno en solución básica. Comenzando con un 1-alqueno, se puede preparar un alcohol primario en dos pasos:
Esta secuencia complementa la hidratación directa de 1-alquenos, lo que da alcoholes secundarios:
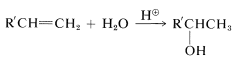
La hidroboración de un alqueno y las reacciones posteriores del producto trialquilborano, ya sea con peróxido de hidrógeno o con ácido, parecen ser altamente estereoespecíficas. Por ejemplo, el 1-metilciclopenteno da exclusivamente trans -2-metilciclopentanol en la hidroboración seguido de reacción con peróxido de hidrógeno alcalino. Esto indica que, en general, las reacciones dan como resultado la adición suprafacial de agua al doble enlace:

La hidroboración de un alquino seguida del tratamiento del alquenilborano con peróxido básico proporciona un método de síntesis de aldehídos y cetonas. Así, la hidroboración del 1-hexino y la oxidación del 1-hexenilborano\(4\), con peróxido de hidrógeno da hexanal por medio del enol:
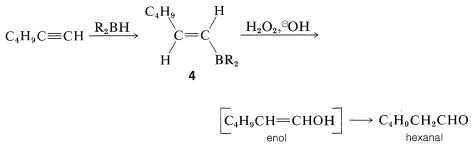
Si\(4\) se trata con ácido deuteriopropanoico, la sustitución de\(\ce{-BR_2}\) por deuterio ocurre con retención de configuración, formando trans -hexeno-1-\(\ce{D_1}\):
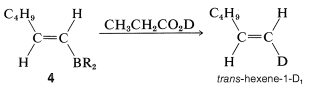
Mecanismo de Oxidación de Alquilboranos
La oxidación estereoespecífica de los alquilboranos ocurre con peróxido de hidrógeno por un interesante e importante tipo general de reordenamiento que, para estas reacciones, implica la migración de un grupo orgánico del boro al oxígeno. El primer paso en la oxidación depende de que el boro tricoordinado tiene sólo seis electrones en su caparazón de valencia y por lo tanto se comporta como si fuera deficiente en electrones. La primera etapa es la formación de enlaces en boro por el anión peróxido fuertemente nucleófilo (de\(\ce{H_2O_2} + \ce{OH}^\ominus \rightleftharpoons ^\ominus \ce{OOH} + \ce{H_2O}\)) para dar un intermedio de boro tetracovalente:

En la segunda etapa, un grupo alquilo se mueve con su par de electrones de enlace del boro al oxígeno vecino y, al hacerlo, desplaza el ion hidróxido. Se conserva la configuración estereoquímica del\(\ce{R}\) grupo migratorio:
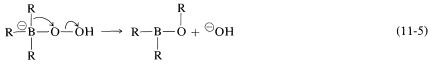
La reacción se completa por hidrólisis del\(\ce{B-O}\) enlace:
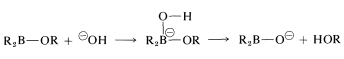
Los tres grupos sobre boro se reemplazan de esta manera.
El paso de reordenamiento (Ecuación 11-5) es un ejemplo de muchos reordenamientos relacionados en los que un grupo\(\ce{R}\),, migra con sus electrones de enlace de un átomo a un átomo adyacente. Ya hemos encontrado un ejemplo en el reordenamiento de los carbocationes (Sección 8-9B):
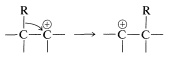
La diferencia entre el reordenamiento de carbocationes y el reordenamiento de la Ecuación 11-5 es que\(\ce{R}\) migra del boro al oxígeno como se\(\ce{HO}^\ominus\) aparta en lo que podría considerarse una\(S_\text{N}2\) reacción interna. Podemos generalizar este tipo de reacción del boro con una sustancia\(\ce{X-Y}\), como en la Ecuación 11-6:
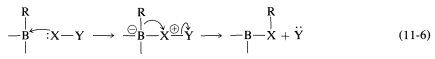
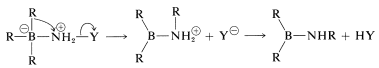
Un ejemplo del uso de un\(\ce{X-Y}\) reactivo es la conversión de alquilboranos en aminas primarias con ácido hidroxilaminasulfónico,\(\ce{H_2NOSO_3H}\) (Ecuación 11-4). Los pasos clave son el ataque del nitrógeno nucleofílico al boro,

seguido de un reordenamiento,
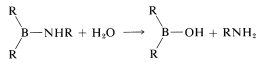
e hidrólisis,
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


