11.7: Reacciones de oxidación
- Page ID
- 73660
Ozonización
La mayoría de los alquenos reaccionan fácilmente con el ozono\(\left( \ce{O_3} \right)\), incluso a bajas temperaturas, para producir derivados peroxídicos cíclicos conocidos como ozónidos. Por ejemplo,
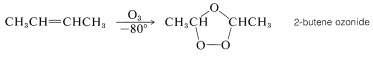
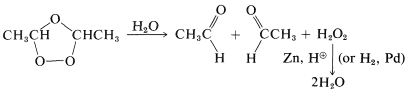
Estas sustancias, como la mayoría de los compuestos con\(\left( \ce{O-O} \right)\) enlaces de peróxido, pueden explotar de manera violenta e impredecible. Por lo tanto, las ozonizaciones deben realizarse con la debida precaución. La importancia general de estas reacciones deriva no de los ozónidos, que por lo general no se aíslan, sino de sus productos posteriores. Los ozónidos se pueden convertir por hidrólisis con agua y reducción, con hidrógeno (catalizador de paladio) o con zinc y ácido, en compuestos carbonílicos que pueden aislarse e identificarse. Por ejemplo, el 2-buteno da etanal en la ozonización, siempre que el ozónido se destruya con agua y un agente reductor que sea efectivo para el peróxido de hidrógeno:
Un procedimiento alternativo para descomponer ozónidos a partir de alquenos di- o trisustituidos es tratarlos con metanol\(\left( \ce{CH_3OH} \right)\). El uso de este reactivo da como resultado la formación de un aldehído o cetona y un ácido carboxílico:

La secuencia general de reacción de ozonización proporciona un medio excelente para localizar las posiciones de los dobles enlaces en alquenos. Las potencialidades del método pueden ilustrarse por la diferencia en los productos de reacción de los 1- y 2-butanos:

Mecanismo de Ozonización
La ozonización de alquenos se ha estudiado extensamente durante muchos años, pero aún existe desacuerdo sobre el mecanismo (o mecanismos) involucrados porque algunos alquenos reaccionan con el ozono para dar productos de oxidación distintos a los ozónidos. Es claro que el ozónido no se forma directamente, sino por medio de un intermedio inestable llamado molozónido. el molozónido entonces isomeriza al ozónido “normal” o participa en otras reacciones de oxidación. Si bien la estructura de los ozónidos normales se ha establecido más allá de toda duda, la del molozónido, que es muy inestable incluso en\(-100^\text{o}\), es mucho menos segura.
El mecanismo más simple y ampliamente aceptado implica la formación de un molozónido mediante una cicloadición directa de ozono al doble enlace. \(^1\)

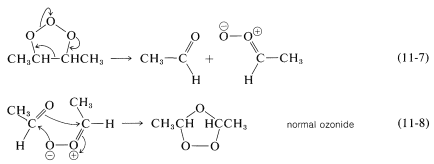
La isomerización del molozónido parece ocurrir por una reacción de fragmentación-recombinación, como se muestra en las Ecuaciones 11-7 y 11-8:
Hidroxilación de Alquenos
Varios reactivos oxidantes reaccionan con alquenos en condiciones suaves para dar, como resultado global, la adición de peróxido de hidrógeno como\(\ce{HO-OH}\). De particular importancia son el permanganato alcalino\(\left( \ce{MnO_4^-} \right)\) y el tetóxido de osmio\(\left( \ce{OsO_4} \right)\), ambos reaccionan en una etapa inicial mediante un mecanismo de cicloadición suprafacial como el postulado para el ozono.
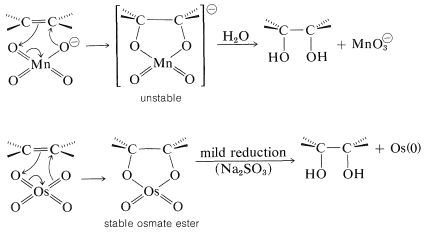
Cada uno de estos reactivos produce compuestos cis-1,2-dihidroxi (dioles) con cicloalquenos:

El tetóxido de osmio es superior al permanganato al dar buenos rendimientos de diol, pero su uso está restringido porque es un reactivo muy costoso y muy tóxico.
Oxidación con Compuestos Peroxídicos. Formación de oxaciclopropano (oxirano)
Los alquenos se pueden oxidar con ácidos peroxicarboxílicos\(\ce{RCO_3H}\),, para dar oxaciclopropanos (oxiranos, epóxidos), que son éteres cíclicos de tres miembros:
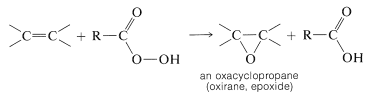
La reacción, conocida como epoxidación, es valiosa porque el anillo de oxaciclopropano se escinde fácilmente, proporcionando así una vía para la introducción de muchos tipos de grupos funcionales. De hecho, la oxidación de alquenos con ácido peroximetanoico (ácido peroxifórmico), preparada mezclando ácido metanoico y peróxido de hidrógeno, generalmente no se detiene en la etapa de oxaciclopropano, sino que conduce a la apertura del anillo y la posterior formación de un diol:

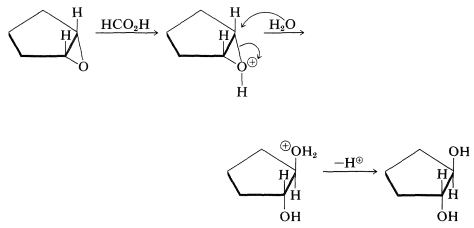
Este es un esquema alternativo para la hidroxilación de alquenos (ver Sección 11-7C). Sin embargo, la estereoquímica global es opuesta a la de la hidroxilación de permanganato. Por ejemplo, el ciclopenteno da trans-1,2-cylcopentandiol. Primero el oxirano se forma por adición suprafacial y luego se abre el anillo para dar el producto trans:

La apertura del anillo es un tipo de\(S_\text{N}2\) reacción. El ácido metanoico es suficientemente ácido para protonar el oxígeno del anillo, lo que lo convierte en un mejor grupo saliente, facilitando así el ataque nucleofílico por el agua. El nucleófilo siempre ataca desde el lado alejado del grupo saliente:
Los peroxiácidos que se utilizan en la formación de oxaciclopropanos incluyen los\(\left( \ce{CF_3CO_3H} \right)\) ácidos peroxietanoico\(\left( \ce{CH_3CO_3H} \right)\), peroxibenzoico\( \left( \ce{C_6H_5CO_3H} \right)\) y trifluoroperoxietanoico. Un peroxiácido particularmente útil es el ácido 3-cloroperoxibenzoico, ya que es relativamente estable y se maneja fácilmente como el sólido cristalino. El reactivo más reactivo es el ácido trifluoroperoxietanoico, lo que sugiere que el peroxiácido se comporta como un electrófilo (la electronegatividad del flúor hace que el\(\ce{CF_3}\) grupo atraiga fuertemente electrones). La reacción global puede verse como una cicloadición, en la que el protón sobre el oxígeno se transfiere al oxígeno carbonilo vecino más o menos simultáneamente con la formación del anillo de tres miembros:

Una reacción de inmensa importancia industrial es la formación del oxaciclopropano mismo (más a menudo llamado óxido de etileno) por oxidación de eteno con oxígeno sobre un catalizador de óxido de plata en\(300^\text{o}\):

El oxaciclopropano se utiliza para muchos propósitos, pero probablemente la reacción más importante es la apertura del anillo con agua para dar 1,2-etandiol (etilenglicol, pb\(197^\text{o}\)). Este diol, mezclado con agua, se emplea ampliamente en sistemas de refrigeración automotriz para proporcionar un refrigerante de mayor punto de ebullición y menor congelación que el agua sola:

El propeno y los alquenos superiores no son epoxidados eficientemente por el oxígeno y\(\ce{Ag_2O}\) de la misma manera que el eteno debido al ataque competitivo en otros carbonos que no sean los de doble enlace.
\(^1\)La estructura de ozono que se muestra aquí con electrones simples que tienen espines emparejados en los oxígenos terminales concuerda tanto con los mejores cálculos mecánicos cuánticos disponibles como con el momento dipolar bajo del ozono, que no está en consonancia con la\(\ce{O=} \overset{\oplus}{\ce{O}} - \overset{\ominus}{\ce{O}}\) estructura convencional. Véase W. A. Goddard III, T. H. Dunning, Jr., W. J. Hunt, y P. J. Hay, Cuentas de Investigación Química 6, 368 (1973).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


