13.5: Alcadienos Acumulados
- Page ID
- 73384
Estructura y Estereoisomería
Los 1,2-dienos, que tienen dobles enlaces acumulados, comúnmente se denominan alenos. El ejemplo más simple es 1,2-propadieno,
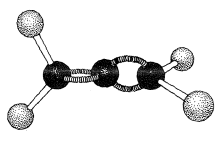
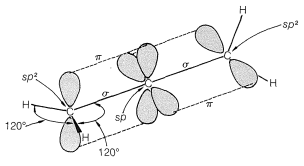
Los alenos del tipo\(\ce{RR'C=C=CRR'}\) son moléculas quirales y pueden existir en dos formas estereoisómeras, siendo una imagen especular de la otra y ninguna superponible sobre la otra (es decir, enantiómeros, Figura 13-5).
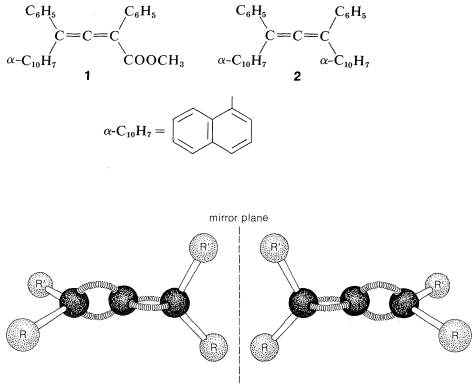
La verificación de la quiralidad de tales alenos (originalmente propuesta por van 't Hoff en 1875) tardó en llegar y fue precedida por muchos intentos fallidos de resolver alenos adecuadamente sustituidos en sus enantiómeros. Las primeras resoluciones exitosas se lograron en 1935 para los enantiómeros de dos compuestos\(1\) y\(2\). Este fue un logro clásico porque disipó la sospecha prevaleciente en ese momento de que la rotación sobre los enlaces del sistema de dienos acumulados era lo suficientemente libre como para evitar el aislamiento de enantiómeros configuracionalmente estables.
La quiralidad observada en este tipo de aleno sustituido es consecuencia de la asimetría resultante de la rotación restringida alrededor de los dobles enlaces, no por un átomo tetraédrico que porta cuatro grupos diferentes. La rotación restringida ocurre en muchos otros tipos de compuestos y algunos ejemplos se muestran en la Tabla 13-3, que incluye trans-cicloalquenos (Sección 12-7), cicloalquilidenos, espiranas y compuestos de bifenilo orto - sustituidos. Para tener enantiómeros, la estructura no debe tener un plano o centro de simetría (Sección 5-5).
Tabla 13-3: Ejemplos de Sustancias Quirales Resultantes de Rotación Restringida Acerca de Doble o Simple Enlace\(^a\)

La quiralidad de los bifenilos resulta de la rotación restringida alrededor de un enlace sencillo impuesto por la naturaleza voluminosa de los sustituyentes orto. Los modelos te ayudarán a visualizar el grado de dificultad de que los sustituyentes pasen unos por otros. Si\(\ce{X} = \ce{H}\) y\(\ce{Y} = \ce{F}\) (Cuadro 13-3), los enantiómeros no son estables a temperatura ambiente; si\(\ce{X} = \ce{H}\) y\(\ce{Y} = \ce{Br}\), son marginalmente estables; si\(\ce{X} = \ce{H}\) y\(\ce{Y} = \ce{I}\), la tasa de pérdida de actividad óptica es aproximadamente 700 veces más lenta que con\(\ce{Y} = \ce{Br}\). Esto concuerda con el hecho de que el tamaño atómico de los halógenos aumenta en el orden\(\ce{F} < \ce{Br} < \ce{I}\).
Isomería cis-Trans
En un trieno acumulado, o cualquier polieno acumulado con un número impar de dobles enlaces, los átomos conectados a los carbonos terminales se encuentran en el mismo plano, tal como lo hacen en un alqueno ordinario. Van 't Hoff señaló que los polienos acumulados adecuadamente sustituidos de este tipo deberían entonces tener formas cis y trans:
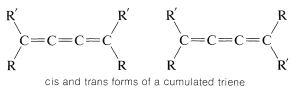
Al igual que la resolución de alenos, la existencia separada de isómeros cis y trans de trienos acumulados no se verificó hasta muchos años después de las predicciones originales de van 't Hoff, pero finalmente se logró una separación, en 1954, por R. Kuhn y K. Scholler para compuestos\(3\) y\(4\):

Se conocen relativamente pocas formas cis-trans de 1,2,3-alcatrienos. Parecen interconvertirse fácilmente en calentamiento suave, lo que sugiere que uno de los dobles enlaces tiene una barrera rotacional más baja de lo normal para un doble enlace alqueno.
Química de los alenos
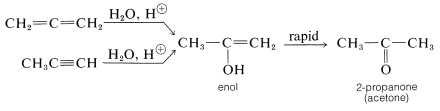
Las propiedades de los alenos son similares a las de los alquenos, aunque los compuestos puros a menudo son difíciles de preparar y no son indefinidamente estables. Los alenos experimentan muchas de las reacciones habituales de doble enlace, siendo fácilmente hidrogenados, añadiendo bromo y oxidándose con solución de permanganato de potasio. La hidratación de los alenos se asemeja a la hidratación de alquinos al dar inicialmente un enol inestable que rápidamente se reorganiza a una cetona:
Los alenos no son tan estables como los dienos con dobles enlaces conjugados o aislados. Los calores de hidrogenación (Cuadro 11-2) indican que el orden de estabilidad son dienos conjugados dienos\(>\) aislados dienos\(>\) acumulados. La inestabilidad relativa de los alenos probablemente refleja una tensión extra como resultado de un átomo de carbono formando dos dobles enlaces. El 1,2-propadieno es ligeramente más tenso que el propino. No es sorprendente entonces que el 1,2-propadieno isomeriza a propino. Esta isomerización se produce bajo la influencia de sustancias fuertemente básicas como la amida de sodio en amoníaco líquido o el hidróxido de potasio en alcohol etílico:

De hecho, una de las dificultades asociadas con la síntesis de alenos y alquinos (que a menudo se llevan a cabo en presencia de bases fuertes) es la formación concurrente de productos de isomerización.
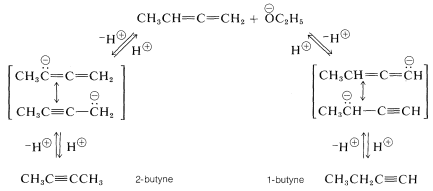
El catalizador básico en la isomerización de 1,2-butadieno a butinos actúa eliminando un protón alquénico del hidrocarburo. Se pueden formar dos aniones diferentes, cada uno de los cuales se estabiliza por deslocalización de electrones que involucra el enlace múltiple adyacente. Cualquiera de los aniones puede reaccionar con el disolvente por transferencia de protones para formar el material de partida o un alquino. En equilibrio predomina el producto más estable, que es 2-butino, [\(\left( g \right) \rightleftharpoons\)\(\left( g \right)\)\(\Delta G^0 = -4.0 \: \text{kcal mol}^{-1}\)1-butino-2-butino,]:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


