14.4: Haluros de alquilo
- Page ID
- 73355
La importante química de los haluros de alquilo,\(\ce{RX}\), incluye las\(\left( E \right)\) reacciones de\(\left( S_\text{N} \right)\) desplazamiento nucleofílico y eliminación discutidas en el Capítulo 8. Recordemos que los haluros de alquilo terciario normalmente son reactivos en\(\left( S_\text{N}1 \right)\) las reacciones de ionización, mientras que los haluros primarios, y en menor medida los haluros secundarios, son reactivos en\(S_\text{N}2\) las reacciones, las cuales ocurren por un mecanismo concertado con inversión de configuración ( Secciones 8-4 a 8-7).
La eliminación compite con la sustitución en muchas\(S_\text{N}\) reacciones y puede convertirse en la vía principal a altas temperaturas o en presencia de base fuerte. La eliminación\(\left( E_2 \right)\), a diferencia del desplazamiento\(\left( S_\text{N}2 \right)\), es insensible al impedimento estérico en el haluro de alquilo. De hecho, la\(E_2\) reactividad de los haluros de alquilo es tert\(\ce{RX} >\) sec\(\ce{RX} >\) prim\(\ce{RX}\), que es opuesta a su\(S_\text{N}2\) reactividad.

Varias reacciones útiles para la síntesis de haluros de alquilo que ya hemos encontrado se resumen a continuación con referencias a las secciones que proporcionan más detalle:

En la Tabla 14-5 se presenta un resumen de estas y algunas otras reacciones para la síntesis de haluros de alquilo o compuestos organohalógenos.
Halidos alílicos (2-propenil)
Los compuestos halógenos en los que el enlace carbono-halógeno es adyacente a un doble bon, como en se conocen como haluros alílicos. El ejemplo más simple es el 3-cloropropeno\(\ce{CH_2=CHCH_2Cl}\), que se elabora a gran escala por la cloración radical del propeno en\(400^\text{o}\):
se conocen como haluros alílicos. El ejemplo más simple es el 3-cloropropeno\(\ce{CH_2=CHCH_2Cl}\), que se elabora a gran escala por la cloración radical del propeno en\(400^\text{o}\):

La mayor parte del 3-cloropropeno preparado de esta manera se convierte en otros compuestos importantes. Por ejemplo, la adición de ácido hipocloroso da una mezcla de dicloropropanoles, que al tratarse con base da una sustancia conocida comercialmente como “epiclorhidrina”:

La reacción de cierre del anillo con\(\ce{Ca(OH)_2}\) es una\(S_\text{N}2\) reacción interna. El ion hidróxido convierte el alcohol en un ion alcóxido que actúa como nucleófilo en el desplazamiento del cloro vecino:

La epiclorhidrina así producida se utiliza principalmente para elaborar resinas epoxi (ver Sección 29-5E), aunque parte de ella se hidroliza a glicerol:

Un método general para preparar haluros alílicos es mediante la adición de haluros de hidrógeno a dienos conjugados. Esta reacción generalmente produce una mezcla de productos de adición 1,2 y 1,4-( ver Sección 13-2):

Un segundo método general consiste en la bromación de alqueno con N-bromosuccinimida (la reacción de Wohl-Ziegler). Una reacción radical-cadena tiene lugar entre la N-bromosuccinimida (NBS) y los alquenos, que comúnmente se inicia por luz, peróxidos u otros catalizadores, y produce bromuros alílicos:

Esta reacción, al igual que la cloración del propeno, es altamente selectiva ya que el llamado alílico\(\ce{C-H}\) es atacado preferencialmente.
De las energías de enlace (Cuadro 4-6) sabemos que los\(\ce{C-H}\) enlaces más débiles del propeno son a los hidrógenos alílicos,\(\ce{H_2C=CHCH_2-H}\). Por lo tanto, en el primer paso de la cloración de propeno en cadena radical, se elimina un hidrógeno alílico por un átomo de cloro (Ecuación 14-1). Los\(\ce{C-H}\) enlaces alílicos son más débiles que los alquénicos\(\ce{C-H}\) debido a la estabilización extra del radical obtenido en la abstracción de hidrógeno (Ecuación 14-1). Se pueden escribir dos estructuras equivalentes de enlace de valencia (\(1a\)y\(1b\)) para el radical 2-propenilo; la deslocalización de electrones mejora la estabilidad del radical (ver Sección 6-5C):

En la segunda etapa de la reacción en cadena (Ecuación 14-2), el radical propenilo puede formar un enlace carbono-halógeno en cualquier extremo al abstraer un átomo de halógeno del agente halogenante:

El\(\ce{Cl} \cdot\) átomo producido ahora puede participar en la Reacción 14-1, continuando así la cadena. Con propeno el radical intermedio da el mismo producto, cloruro de 2-propenilo, independientemente de que un átomo de cloro se transfiera al carbono 1 o 3. Sin embargo, el radical formado por la eliminación de un hidrógeno alílico del 2-buteno da una mezcla de productos:
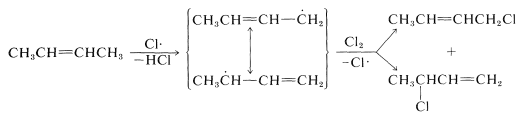
\(S_\text{N}\)Reacciones de haluros alílicos
Los enlaces carbono-halógeno de los haluros alílicos son especialmente reactivos en ambas\(S_\text{N}1\) y\(S_\text{N}2\) reacciones (Cuadro 14-6). Las razones de la\(S_\text{N}1\) reactividad mejorada han sido discutidas previamente (Sección 8-7B). Por ejemplo, la facilidad con la que se ioniza 1-cloro-2-buteno en comparación con el 1-clorobutano se atribuye a la estabilidad del catión 2-butenilo, que se distribuye entre\(\ce{C_1}\) y\(\ce{C_3}\), y el nucleófilo (agua) ataca en ambas posiciones para dar mezclas de productos. Se obtienen los mismos resultados si se inicia con 3-cloro-1-buteno porque se forma el mismo catión:



Halidos bencílicos (fenilmetil)
Las reactividades comparables a los haluros alílicos se encuentran en las reacciones de desplazamiento nucleofílico de haluros bencílicos por\(S_\text{N}1\) y\(S_\text{N}2\) mecanismos (Cuadro 14-6). La capacidad de los haluros bencílicos para experimentar\(S_\text{N}1\) reacciones claramente está relacionada con la estabilidad de los cationes bencílicos resultantes, cuyos electrones están extensamente deslocalizados. Así, para el cloruro de fenilmetilo,

Cuando el sustituyente halógeno está localizado a dos o más carbonos del grupo arilo como en el bromuro de 2-feniletilo\(\ce{C_6H_5CH_2CH_2Br}\), el pronunciado efecto activador evidente en haluros bencílicos desaparece, y la reactividad de los haluros es esencialmente la de un haluro de alquilo primario (por ejemplo,\(\ce{CH_3CH_2CH_2Br}\)).
Los haluros bencílicos se pueden preparar mediante los mismos agentes halogenantes radicales que dan haluros alílicos a partir de alquenos. Estos incluyen\(\ce{Cl_2}\)\(\ce{Br_2}\), N-bromosuccinimida (Sección 14-3A)\(\ce{SO_2Cl_2}\), e hipoclorito de terc- butilo:

El\(\ce{C-H}\) enlace bencílico es más débil y más restrictivo que\(\ce{C-H}\) los enlaces alcanos primarios debido a la estabilización de los radicales bencílicos (ver Cuadro 4-6).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


