14.7: Halidos de Arilo
- Page ID
- 73322
Los haluros de arilo tienen un halógeno unido directamente a un carbono de un anillo aromático. Ejemplos son bromobenceno, fluorobenceno y 2,4-diclorometilbenceno:

Algunos de los métodos mediante los cuales se preparan haluros de alquilo no funcionan para haluros de arilo porque es difícil formar enlaces\(\ce{C}\) -halógeno en carbonos de anillos aromáticos mediante reacciones de desplazamiento nucleófilo. Las formas más comunes de formar enlaces\(\ce{C}_\text{aryl}\) -halógeno son mediante la sustitución de\(\ce{C}_\text{aryl} \ce{-H}\) por agentes halogenantes electrófilos (por ejemplo,\(\ce{Br_2}\) o\(\ce{Cl_2}\)),

y por sustitución de\(\ce{C-NH_2}\) por\(\ce{C}-\) halógeno. Estas reacciones se enumeran en el Cuadro 14-5 y serán discutidas con más detalle en los Capítulos 22 y 23.
Reacciones de desplazamiento aromático nucleófilo
Los enlaces carbono-halógeno de los haluros de arilo son como los de los haluros de alquenil al ser mucho más fuertes que los de los haluros de alquilo (ver Cuadro 4-6). Los haluros de arilo simples generalmente son resistentes al ataque de nucleófilos en cualquiera\(S_\text{N}1\) o\(S_\text{N}2\) reacciones (Cuadro 14-6). Sin embargo, esta baja reactividad puede cambiarse drásticamente por cambios en las condiciones de reacción y la estructura del haluro de arilo. De hecho, el desplazamiento nucleofílico se vuelve bastante rápido (a) cuando el haluro de arilo se activa por sustitución con grupos fuertemente atrayentes de electrones tales como\(\ce{NO_2}\), y (b) cuando se utilizan reactivos nucleofílicos muy fuertemente básicos.
Mecanismo de Adición-Eliminación de Sustitución Nucleofílica
Aunque los haluros de arilo simples son inertes a los reactivos nucleofílicos habituales, se produce una activación considerable por sustituyentes fuertemente atrayentes de electrones siempre que estos se localicen en las posiciones orto o para, o en ambas. Por ejemplo, el desplazamiento del ion cloruro del 1-cloro-2,4-dinitrobenceno por la dimetilamina ocurre fácilmente en solución de etanol a temperatura ambiente. Bajo las mismas condiciones el clorobenceno no reacciona completamente; así la influencia activadora de los dos grupos nitro asciende a un factor de al menos\(10^8\):
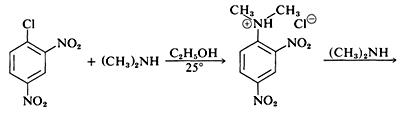
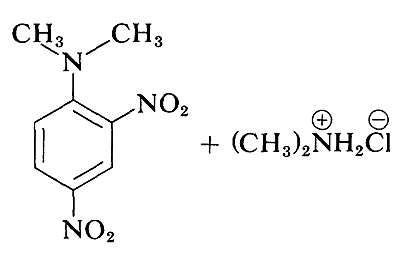
Una reacción relacionada es la del 2,4-dinitrofluorobenceno con los grupos amino de péptidos y proteínas, y esta reacción proporciona un medio para el análisis de los aminoácidos N-terminales en las cadenas polipeptídicas. (Ver Sección 25-7B.)
En general, las reacciones de haluros de arilo activados se asemejan mucho a las reacciones de\(S_\text{N}2\) desplazamiento de haluros alifáticos. Los mismos reactivos nucleofílicos son efectivos (e.g.\(\ce{CH_3O}^\ominus\),\(\ce{HO}^\ominus\), y\(\ce{RNH_2}\)); las reacciones son de segundo orden global (primer orden en haluro y primer orden en nucleófilo); y para un haluro dado cuanto más nucleófilo sea el reactivo de ataque, más rápida es la reacción. Sin embargo, debe haber más que una sutil diferencia en el mecanismo porque un haluro de arilo es incapaz de pasar por el mismo tipo de estado de transición que un haluro de alquilo en\(S_\text{N}2\) los desplazamientos.
El mecanismo generalmente aceptado de sustitución aromática nucleófila de haluros de arilo portadores de grupos activadores implica dos etapas que son muy análogas a las descritas brevemente en la Sección 14-4 para haluros de alquinilo y alquinilo. El primer paso implica el ataque del nucleófilo\(\ce{Y}^\ominus\) en el carbono que porta el sustituyente halógeno para formar un carbanión intermedio\(4\) (Ecuación 14-3). El sistema aromático se destruye al formar el anión, y el carbono en el sitio de reacción cambia de plano (\(sp^2\)enlaces) a tetraédrico (\(sp^3\)enlaces).

En la segunda etapa, la pérdida de un anión,\(\ce{X}^ominus\) o\(\ce{Y}^\ominus\), regenera un sistema aromático, y, si\(\ce{X}^\ominus\) se pierde, la reacción global es el desplazamiento nucleofílico de\(\ce{X}\) by\(\ce{Y}\) (Ecuación 14-4).

En el caso de un reactivo nucleófilo neutro,\(\ce{Y}\) o bien\(\ce{HY}\), la secuencia de reacción sería la misma salvo los ajustes necesarios en la carga del intermedio:
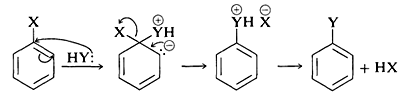
¿Por qué esta vía de reacción es generalmente desfavorable para los haluros de arilo simples? La respuesta es que el intermedio\(4\), que podemos expresar como un híbrido de las estructuras de enlace de valencia\(4a\) -\(4c\), es demasiado alto en energía para formarse a cualquier ritmo práctico. No solo ha\(4\) perdido la estabilización aromática del anillo de benceno, sino que su formación da como resultado la transferencia de carga negativa a los carbonos del anillo, que en sí mismos no son muy electronegativos:

Sin embargo, cuando los grupos atrayentes de electrones están localizados en el anillo en las posiciones orto-para, el anión intermedio se estabiliza por deslocalización de electrones de los carbonos del anillo a ubicaciones más favorables en los grupos sustituyentes. Como ejemplo, considere el desplazamiento del bromo por\(\ce{OCH_3}\) en la reacción del 4-bromonitrobenceno y el ion metóxido:
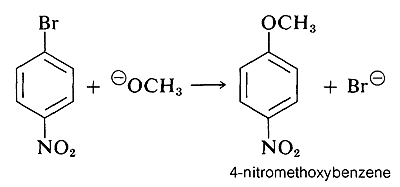
El intermedio aniónico formado por adición de ion metóxido al haluro de arilo se puede describir por las estructuras de enlace de valencia\(5a\) -\(5d\). De estas estructuras\(5d\) es especialmente importante porque en ella la carga se transfiere desde los carbonos del anillo al oxígeno del sustituyente nitro:
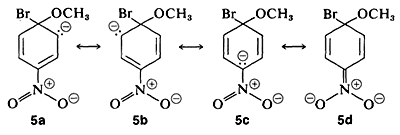
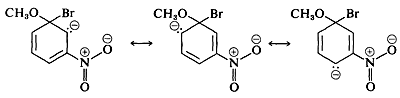
Los sustituyentes en las posiciones meta tienen mucho menos efecto sobre la reactividad de un haluro de arilo porque no es posible la deslocalización de electrones al sustituyente. No se pueden escribir fórmulas análogas a\(5c\) y\(5d\) en las que las cargas negativas estén ambas en átomos próximos al nitrógeno positivo,\(\overset{\ominus}{\ce{C}} \overset{\oplus}{\ce{-N}-} \overset{\ominus}{\ce{O}}\) y\(\overset{\ominus}{\ce{O}} \overset{\oplus}{\ce{-N}-} \overset{\ominus}{\ce{O}}\),
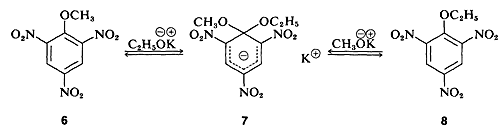
En algunos casos, se han aislado compuestos estables que se asemejan al intermedio de reacción postulado. Un ejemplo clásico es el complejo\(7\) (aislado por J. Meisenheimer), que es el producto de la reacción del metil aril éter 6\(6\) con etóxido de potasio, o del etil aril éter\(8\) y metóxido de potasio:
Mecanismo de Eliminación-Adición de Sustitución Aromática Nucleofílica. Arynes
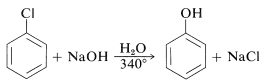
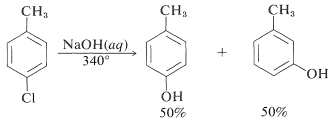
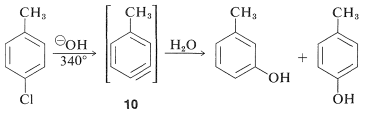
Las reactividades de los haluros de arilo, tales como los halobencenos, son extremadamente bajas hacia reactivos nucleofílicos que normalmente efectúan desplazamientos con haluros de alquilo y haluros de arilo activados. Las sustituciones ocurren bajo condiciones forzadas de altas temperaturas o bases muy fuertes. Por ejemplo, el clorobenceno reacciona con solución de hidróxido de sodio a temperaturas cercanas\(340^\text{o}\) y esta reacción fue una vez un proceso comercial importante para la producción de bencenol (fenol):
Además, los cloruros, bromuros y yoduros de arilo pueden convertirse en arenaminas\(\ce{ArNH_2}\) por las bases conjugadas de aminas. De hecho, la reacción de la amida potásica con bromobenceno es extremadamente rápida, incluso a temperaturas tan bajas como\(-33^\text{o}\) con amoníaco líquido como disolvente:
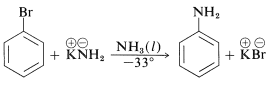
Sin embargo, las reacciones de desplazamiento de este tipo difieren de los desplazamientos previamente discutidos de haluros de arilo activados en que a menudo se produce un reordenamiento. Es decir, el grupo entrante no siempre ocupa la misma posición en el anillo que la desocupada por el sustituyente halógeno. Por ejemplo, la hidrólisis de 4-clorometilbenceno\(340^\text{o}\) da una mezcla equimolar de 3- y 4-metilbencenoles:
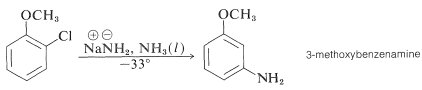
Aún más llamativa es la formación exclusiva de 3-metoxibencenamina en la aminación de 2-clorometoxibenceno. Observe que este resultado es una violación del principio de menor cambio estructural (Sección 1-1H):
El mecanismo de este tipo de reacción ha sido estudiado extensamente, y se han acumulado muchas pruebas en apoyo de un proceso paso a paso, que procede primero por la eliminación catalizada por base del haluro\(\left( \ce{HX} \right)\) de hidrógeno del haluro de arilo, como se ilustra a continuación para la aminación del bromobenceno:
Eliminación
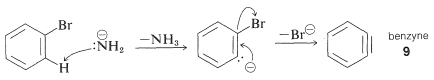
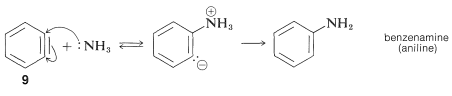
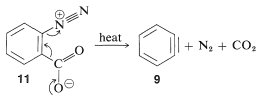
El producto de la reacción de eliminación es un intermedio altamente reactivo\(9\) llamado benzino, o deshidrobenceno, que difiere del benceno en tener dos menos hidrógeno y un enlace extra entre dos orto carbonos. El benzino reacciona rápidamente con cualquier nucleófilo disponible, en este caso el disolvente, amoníaco, para dar un producto de adición:
Adición
Los reordenamientos en estas reacciones resultan del ataque del nucleófilo en uno u otro de los carbonos del enlace extra en el intermedio. Con el benzino la simetría es tal que no se detectaría ningún reordenamiento. Con benzinas sustituidas pueden resultar productos isoméricos. Así, 4-metilbenzino\(10\), a partir de la reacción del ion hidróxido con 4-cloro-1-metilbenceno da tanto 3- como 4-metilbencenoles:
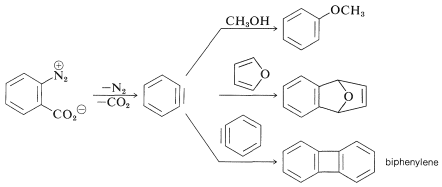
En las reacciones bencinas anteriores la base que produce el benzino en la etapa de eliminación se deriva del nucleófilo que se añade en la etapa de adición. Esto no siempre tiene que ser así, dependiendo de las condiciones de reacción. De hecho, la utilidad sintética de las reacciones de arino depende en gran parte del éxito con el que el arino puede ser generado por un reactivo pero capturado por otro. Uno de tales métodos se discutirá en la Sección 14-10C e implica compuestos organometálicos derivados de haluros de arilo. Otro método es generar el arino por descomposición térmica de un compuesto de areno 1,2-disustituido tal como\(11\), en el que ambos sustituyentes son grupos lábiles - uno que sale con un par de electrones, el otro dejando sin:
Cuando se\(11\) descompone en presencia de un nucleófilo agregado, el intermedio bencino es atrapado por el nucleófilo a medida que se forma. O bien, si está presente un dieno conjugado, el benzino reaccionará con él mediante una cicloadición [4 + 2]. En ausencia de otros compuestos con los que pueda reaccionar, el benzino sufrirá [2 + 2] cicloadición a sí mismo:
Usos para compuestos de halógeno de arilo
Como ocurre con la mayoría de los haluros orgánicos, los haluros de arilo suelen ser intermedios sintéticos para la producción de otras sustancias útiles. Por ejemplo, el clorobenceno es el haluro de arilo de partida para la síntesis de DDT; también es fuente de bencenol (fenol, Sección 14-6C) que, a su vez, tiene muchos usos (Sección 26-1).
Varios compuestos aromáticos de cloro se utilizan ampliamente como insecticidas, herbicidas, fungicidas y bactericidas. También han adquirido mucha notoriedad porque en algunos casos su uso indiscriminado ha provocado serios problemas. Por ejemplo, el hexaclorofeno es un bactericida externo que hasta hace poco se usaba en preparaciones cosméticas como jabones, desodorantes, etc. Su uso ha sido discontinuado debido a pruebas convincentes de que puede ser absorbido a través de la piel en cantidades que son peligrosas, si no letales, para bebés y niños pequeños.

Otros plaguicidas, en particular el DDT y los herbicidas 2,4-D y 2,4,5-T han sido parcialmente prohibidos por diferentes razones.

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


