14.8: Alcanos y Alquenos Polihalogenados
- Page ID
- 73351
Compuestos útiles
La policloración del metano produce los di-, tri- y tetraclorometanos de manera económica y eficiente:

Estas sustancias tienen excelentes propiedades solventes para sustancias no polares y ligeramente polares. El cloroformo una vez fue ampliamente utilizado como anestésico por inhalación. Sin embargo, tiene un efecto perjudicial sobre el corazón y es oxidado lentamente por el oxígeno atmosférico a dicloruro de carbonilo altamente tóxico (fosgeno,\(\ce{COCl_2}\)). El cloroformo comercial contiene aproximadamente\(1\%\) etanol, que destruye cualquier\(\ce{COCl_2}\) formado por oxidación.
El tetracloruro de carbono se empleó comúnmente como solvente de limpieza, aunque su considerable toxicidad conlleva un peligro considerable cuando se usa indiscriminadamente. Se ha utilizado como fluido extintor de incendios para incendios de petróleo, pero su toxicidad y tendencia a formar dicloruro de carbonilo aún más tóxico lo hace indeseable para áreas confinadas. La práctica común de laboratorio de eliminar trazas de agua de solventes con sodio metálico no debe aplicarse a compuestos halogenados; las mezclas de tetracloruro de carbono-sodio son sensibles a los golpes y pueden detonar.
El tricloroeteno (“Tri-Clene”, bp\(87^\text{o}\)) es un disolvente de limpieza en seco ampliamente utilizado. Se puede preparar a partir de eteno o etino:

En comparación con los monohaloalcanos, los compuestos polihalógenos tienen reactividades y comportamiento bastante diferentes hacia nucleófilos y bases. Así, el diclorometano reacciona con el ion hidróxido por un\(S_\text{N}2\) mecanismo mucho menos fácil que el cloruro de metilo. El clorometanol formado luego se somete a una rápida\(E2\) eliminación para dar metanal (formaldehído), una sustancia que existe en el agua en gran parte como dihidroximetano:

El triclorometano (cloroformo) reacciona de manera bastante diferente con la base que el clorometano o el diclorometano -como se describirá en la siguiente sección.
\(\alpha\)Eliminación. Carbenos
Los trihalometanos, como el triclorometano (cloroformo), son bastante reactivos hacia una base fuerte. La base, como el hidróxido, elimina el hidrógeno de\(\ce{HCCl_3}\) como protón mucho más rápidamente de lo que ataca al carbono de la\(S_\text{N}2\) manera. El carbanión así formado\(\ce{Cl_3C}^\ominus\),, es inestable y pierde ión cloruro para formar un intermedio neutro altamente reactivo,\(:\ce{CCl_2}\), llamado diclorocarbeno:

Este intermedio tiene solo seis electrones de valencia alrededor del carbono y por lo tanto es fuertemente electrofílico. En solución acuosa reacciona rápidamente para formar monóxido de carbono e ion metanoato (formiato):

La formación de\(:\ce{CCl_2}\) desde\(\ce{HCCl_3}\) por las reacciones de la Ecuación 14-6 da como resultado la eliminación de\(\ce{HCl}\) - los grupos salientes,\(\ce{H}\) y\(\ce{Cl}\), ambos originados del mismo átomo de carbono. Tales reacciones no son infrecuentes y se denominan\(\alpha\) eliminaciones o 1,1 eliminaciones para\(E2\) distinguirlas\(E1\) y reacciones, que son\(\beta\) eliminaciones o 1,2 eliminaciones. Aún otras posibilidades son reacciones como\(\gamma\) o 1,3 eliminaciones, pero éstas adquieren el carácter de\(S_\text{N}2\) reacciones internas y no serán consideradas en detalle aquí.

El producto de\(\alpha\) la eliminación es una especie neutra que se asemeja a un carbocatión al tener solo seis electrones de valencia de carbono. El carbeno más simple es\(:\ce{CH_2}\), el metileno. Los carbenos son altamente reactivos, tanto es así que no se pueden aislar. Su implicación en las reacciones suele inferirse de la naturaleza de los productos o de la cinética de la reacción. Las reacciones carbeno características implican formar un enlace de par de electrones al carbono de carbeno al reaccionar con\(\sigma\)\(\pi\) enlaces, enlaces o pares no compartidos\(\left( n \right)\). Algunas de estas reacciones se ilustran aquí para el metileno\(:\ce{CH_2}\). \(^1\)
con\(\sigma\) enlaces (inserción):

con\(\pi\) enlaces ([2 + 1] cicloadición):

con pares no compartidos (dimerización, adición):

Los carbenos son mucho más reactivos hacia los dobles enlaces carbono-carbono que hacia los enlaces simples. Sin duda, la característica más útil de\(\alpha\) eliminación es que proporciona una ruta práctica a ciclopropanos y ciclopropenos mediante [2 + 1] cicloadición de carbenos a dobles o triples enlaces. Estas adiciones son adiciones suprafaciales estereoespecíficas si involucran carbenos singlete, pero pueden dar mezclas con carbenos triplete:

Los precursores de carbeno son compuestos que tienen o adquieren buenos grupos salientes (por ejemplo, iones haluro). Así, los compuestos halógenos frecuentemente son fuentes de carbeno. Los trihalometanos son las fuentes más antiguas conocidas de dihalocarbenos; pero existen otros métodos para generar carbenos, y algunos de estos se enumeran como referencia en el Cuadro 14-2 (véase también la Sección 14-10C). Se cuestiona si realmente se forma un carbeno “libre” en algunas de estas reacciones, particularmente las que involucran metales, pero para nuestros fines los clasificaremos como rutas a carbenos o especies similares a los carbenos.
Tabla 14-2: Reacciones\(\alpha\) de eliminación que producen intermedios de carbeno\(^a\)

Muchos carbenos, como los carbocationes, se reorganizan a estructuras más estables por la migración de un grupo vecino al carbono deficiente en electrones. Así, el fenilmetilcarbeno se reorganiza a etenilbenceno (estireno):

Fluoroclorometanos
La sustitución de uno o dos de los cloros del tetracloruro de carbono por flúor se puede lograr fácilmente con trifluoruro de antimonio que contiene algo de pentacloruro de antimonio. La reacción se detiene después de que dos cloros hayan sido reemplazados. El trifluoruro de antimonio puede regenerarse continuamente a partir del cloruro de antimonio mediante la adición de fluoruro de hidrógeno anhidro:

Ambos productos son útiles como refrigerantes, particularmente para refrigeradores domésticos y unidades de aire acondicionado, bajo el nombre comercial Freón. El difluorodiclorometano (Freón 12) también se emplea como propulsor en bombas de aerosol, dispensadores de crema para afeitar y otros recipientes similares. Es no tóxico, inodoro, no inflamable, y no reaccionará con ácidos minerales concentrados calientes o sodio metálico. Esta falta de reactividad es generalmente característica del grupo difluorometileno, siempre que los fluorinos no estén localizados sobre un carbono insaturado. La unión de un átomo de flúor a un átomo de carbono unido a uno o más átomos de cloro tiende en gran medida a reducir la reactividad de los cloros hacia casi todos los tipos de reactivos. Los posibles problemas ambientales asociados a estas sustancias fueron discutidos en la introducción de este capítulo.
Fluorocarbonos
Durante la Segunda Guerra Mundial, se requirieron plásticos y compuestos lubricantes de inusual estabilidad química y térmica para muchas aplicaciones, en particular para aparatos de bombeo utilizados para\(\ce{^{235}U}\) separarse\(\ce{^{238}U}\) por difusión de hexafluoruro de uranio corrosivo a través de barreras porosas. Era natural considerar el uso de sustancias hechas únicamente de carbono y flúor (fluorocarbonos) para tales fines, y se gastó un esfuerzo considerable en métodos de preparación de compuestos como\(\ce{-(CF_2)}-_n\). Hoy en día, muchas de esas sustancias son de uso común. Estos a menudo se llaman compuestos “perfluoro-”, lo que indica que todos los hidrógenos disponibles del compuesto parental son reemplazados por flúor. Así es perfluorociclohexano\(\ce{(CF_2)_6}\). Un perfluorocarbono ampliamente utilizado es el material plástico\(\ce{-(CF_2)}-_n\), que se produce en cantidad por polimerización radical de tetrafluoroeteno:

El producto (“Teflon”) es una sustancia sólida, químicamente inerte que es estable alrededor\(300^\text{o}\). Hace excelentes materiales de aislamiento eléctrico y juntas. También tiene propiedades autolubricantes, las cuales se explotan en la preparación de superficies de baja adherencia (como sartenes “antiadherentes”) y cojinetes de trabajo ligero.
El tetrafluoroeteno se puede hacer a escala comercial por el siguiente método:
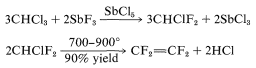
Esta última reacción implica difluorocarbeno\(\left( :\ce{CF_2} \right)\):

En presencia de peróxidos, el tetrafluoroeteno se polimeriza al polímero de cadena larga. Si se excluyen los peróxidos, se produce [2 + 2] cicloadición con alto rendimiento para dar octafluorociclobutano (ver Sección 13-3D):

Reacciones similares de cicloadición ocurren con clorotrifluoroeteno y 1,1-dicloro-2,2-difluoroeteno.
La polimerización radical del clorotrifluoroeteno da un polímero útil (Kel-F) que es similar al Teflon.
Un excelente elastómero de alta resistencia química (Viton) se puede elaborar copolimerizando hexafluoropropeno con 1,1-difluoroeteno. El producto es estable\(300^\text{o}\) y no es atacado por el ácido nítrico concentrado caliente. Aunque es caro, no tiene rival entre los elastómeros para la durabilidad química en condiciones extremas.
Propiedades de Fluorocarbonos
Los fluorocarbonos tienen puntos de ebullición extraordinariamente bajos en relación con los hidrocarburos de peso molecular comparable. Como se ve en la Figura 14-3, sus puntos de ebullición son casi los mismos o incluso menores que los de los alcanos o cicloalcanos con el mismo número de carbonos. Así, el octafluorociclobutano o hierve más\(17^\text{o}\) bajo que el ciclobutano, ¡a pesar de un peso molecular casi cuatro veces mayor!

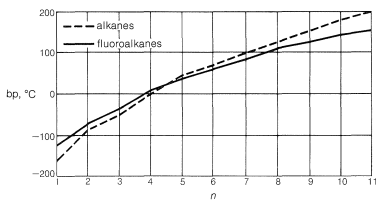
Los fluorocarbonos son muy insolubles en la mayoría de los disolventes polares y solo son ligeramente solubles en alcanos en el rango de queroseno. Los fluorocarbonos de mayor peso molecular ni siquiera son miscibles en todas las proporciones con sus homólogos de menor peso molecular.
Las propiedades fisiológicas de los compuestos organofluorinos varían ampliamente. El diclorodifluorometano y los fluorocarbonos saturados parecen ser completamente no tóxicos. Por el contrario, el perfluoro-2-metilpropeno es extremadamente tóxico, más que el gas de guerra, el dicloruro de carbonilo\(\left( \ce{COCl_2} \right)\). El fluoroetanoato de sodio\(\left( \ce{CH_2FCO_2Na} \right)\) y el 2-fluoroetanol son derivados de flúor tóxicos de sustancias orgánicas que contienen oxígeno. La sal fluoroetanoato se vende comercialmente como rodenticida. Curiosamente, el trifluoroetanoato de sodio no es tóxico.
Los derivados fluorocarbonados tienen otra propiedad interesante y potencialmente útil. Ellos disuelven grandes cantidades de oxígeno. Este hecho, combinado con su no toxicidad, ha llevado a su uso como reemplazos de sangre en cirugía cardíaca en animales de experimentación. Los ratones pueden vivir totalmente sumergidos en fluorocarbonos líquidos saturados de oxígeno.
\(^1\)La vida con carbenos se complica sustancialmente por el hecho de que existen dos formas diferentes (singlete y triplete) de\(:\ce{CH_2}\) y presumiblemente de todos los demás carbenos. Las dos formas de\(:\ce{CH_2}\) difieren considerablemente en su reactividad. Uno es el singlete, que tiene sus electrones no compartidos emparejados, mientras que el otro es el triplete con los mismos electrones desapareados. Porque\(:\ce{CH_2}\), la forma singlete es la menos estable y más reactiva, mientras que con\(:\ce{CCl_2}\), el triplete es la menos estable y más reactiva.
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


