14.11: Preparación de Compuestos Organometálicos
- Page ID
- 73380
Metales con Halouros Orgánicos
La reacción de un metal con un haluro orgánico es un método conveniente para la preparación de compuestos organometálicos de metales razonablemente activos tales como litio, magnesio y zinc. Los éteres, particularmente el éter dietílico y el oxaciclopentano (tetrahidrofurano), proporcionan medios inertes ligeramente polares en los que los compuestos organometálicos suelen ser solubles. Es necesario tener cuidado para excluir la humedad, el oxígeno y el dióxido de carbono, que reaccionarían con el compuesto organometálico. Esto se puede lograr usando una atmósfera inerte de nitrógeno o helio.

El orden de reactividad de los haluros es\(\ce{I} \: > \: \ce{Br} \: > \: \ce{Cl} \: \gg \ce{F}\). Mientras que el magnesio y el litio reaccionan bien con cloruros, bromuros y yoduros, el zinc es satisfactorio solo con bromuros y yoduros. El mercurio solo reacciona cuando se amalgama con sodio. El sodio y el potasio presentan problemas especiales debido a la alta reactividad de los compuestos de alquilsodio y alquilpotasio hacia el éter y los haluros orgánicos. Los disolventes alcanos suelen ser necesarios.
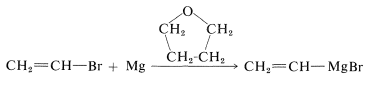
Los haluros de alquinilo, alquinilo y arilo, como los haluros de alquilo, se pueden convertir en los correspondientes compuestos de magnesio y litio. Sin embargo, las condiciones de reacción, tales como la elección del disolvente, pueden ser críticas. El bromoeteno, por ejemplo, se puede convertir en bromuro de etenilmagnesio con buen rendimiento si el disolvente es oxaciclopentano [tetrahidrofurano,\(\ce{(CH_2)_4O}\)]:
Los haluros alílicos y bencílicos más reactivos presentan un problema, no tanto en la formación del derivado organometálico como en evitar que reaccione más con el haluro de partida. Una reacción secundaria a menudo no deseada en la preparación de compuestos organometálicos es una reacción de desplazamiento, probablemente del\(S_\text{N}2\) tipo:
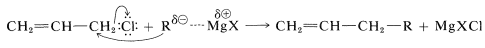
Este problema se puede disminuir en gran medida mediante el uso de un gran exceso de magnesio y soluciones diluidas del haluro alílico para minimizar la reacción de acoplamiento.
La misma dificultad también ocurre en la preparación de compuestos alquilsódicos. El haluro de partida se\(\ce{RX}\) acopla con\(\ce{RNa}\) (para dar\(\ce{R-R}\) y\(\ce{NaX}\)) o se convierte en un alqueno. Estas reacciones parecen implicar intermedios radicales sometidos a combinación y desproporción (Sección 10-8C):

En ausencia de sodio metálico, el etilsodio probablemente todavía reacciona con bromuro de etilo por una reacción radical en lugar de\(S_\text{N}2\) o\(E2\). Esto sucede porque\(\ce{CH_3CH_2^-}\) tiende a perder un electrón fácilmente y puede actuar como sodio metálico para donar un electrón\(\ce{CH_3CH_2Br}\) para formar un radical etilo y convertirse en un radical etilo:

Las reacciones entre los radicales resultantes producen butano, etano y eteno.
El punto en el que se puede esperar\(S_\text{N}2\) y\(E2\) las reacciones van más rápido que la formación de radicales a medida que se cambian las estructuras de los haluros y la naturaleza del metal aún no está claramente definido. Sin embargo, cada vez es más evidente que existen reacciones de sustitución de haluros de arilo “inactivados” que proceden sin reordenamiento por medio de intermedios radicales. El paso clave en estas reacciones es la donación de un electrón a uno de los\(\pi\) orbitales sin llenar del anillo y la posterior expulsión de un ion haluro:

Tal mecanismo probablemente esté involucrado en la formación de compuestos organometálicos a partir de haluros de arilo y metales.
Algunas Otras Preparaciones de Compuestos Organometálicos
A continuación se describen brevemente los métodos menos generales pero muy útiles para formar compuestos organometálicos (véase también el Cuadro 14-7). En cada una de estas preparaciones el disolvente debe ser inerte a todos los compuestos organometálicos involucrados.
Intercambio Halogeno-Metal
\[\ce{RBr} + \ce{R'Li} \rightleftharpoons \ce{RLi} + \ce{R'Br}\]
El equilibrio en estas reacciones favorece la formación del compuesto organometálico con el metal unido al\(\ce{R}\) grupo más electronegativo. El método se utiliza principalmente en la preparación de compuestos de organolitio derivados de haluros no reactivos tales como haluros de arilo, etenilo o etinilo. Estos haluros no siempre reaccionan fácilmente con el litio metálico, pero pueden reaccionar bien con butillitio:

Desplazamiento de un metal por otro
\[\ce{R_2Hg} + 2 \ce{Na} \rightleftharpoons 2 \ce{RNa} + \ce{Hg}\]
Aquí el equilibrio es tal que el\(\ce{R}\) grupo favorece la unión al metal más electropositivo.
Compuestos Organometálicos con Halouros Metálicos
\[\ce{RMgCl} + \ce{HgCl_2} \rightleftharpoons \ce{RHgCl} + \ce{MgCl_2}\]
\[\ce{RLi} + \ce{CuI} \rightleftharpoons \ce{RCu} + \ce{LiI}\]
El equilibrio favorece que los productos\(\ce{R}\) estén conectados al metal menos electropositivo por lo que la reacción tiende a formar un compuesto organometálico menos reactivo a partir de uno más reactivo.
Compuestos Organometálicos a partir de Hidrocarburos Ácidos
Algunos compuestos organometálicos se preparan mejor mediante la reacción de una base fuerte o un derivado de alquil metal con un hidrocarburo ácido, tal como un alquino:

Un ejemplo especialmente importante es el del 1,3-ciclopentadieno, que es ácido porque su base conjugada (anión ciclopentadienuro) se estabiliza en gran medida por deslocalización de electrones. El anión se forma fácilmente a partir del hidrocarburo y metillitio:

Compuestos organometálicos a partir de compuestos polihalógenos
Los compuestos diorganometálicos no se pueden preparar a partir de dihaluros si los halógenos están separados por tres\(\ce{C-C}\) enlaces o menos debido a que la eliminación u otras reacciones suelen predominar. Con metales activos y 1,1-, 1,2- o 1,3-dihaluros, normalmente ocurren las siguientes reacciones:

Cuando los halógenos están separados por al menos cuatro carbonos, se puede formar un compuesto diorganometálico:

Los carbenos,\(\ce{R_2C} :\) (Sección 14-7B) se producen mediante\(\alpha\) eliminaciones de compuestos polihalógenos con reactivos organometálicos. La primera etapa es el intercambio halógeno-metal y esto es seguido por la eliminación del haluro metálico:

Las reacciones de eliminación de este tipo pueden ser útiles en síntesis para la formación de enlaces carbono-carbono. Por ejemplo, si se genera dibromocarbeno en presencia de un alqueno, reaccionará por cicloadición para dar un derivado de ciclopropano:

Un ejemplo relacionado es la generación de benzino a partir de 1-bromo-2-fluorobenceno con magnesio en oxaciclopentano (tetrahidrofurano). Si la temperatura se mantiene alrededor\(0^\text{o}\), se forma bromuro de 2-fluorofenilmagnesio. A temperaturas más altas, se elimina el haluro de magnesio y el benzino da como resultado:

Si un dieno está presente, el bencino reaccionará con él mediante una cicloadición [4 + 2] como en el siguiente ejemplo:

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


