17.3: Halogenación de Aldehídos y Cetonas
- Page ID
- 73570
Síntesis de\(\alpha\) -Halo Cetonas
La halogenación de aldehídos y cetonas saturados generalmente ocurre exclusivamente por reemplazo de hidrógenos alfa al grupo carbonilo:
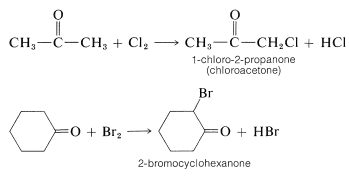
Los reactivos que comúnmente se utilizan para halogenar compuestos carbonílicos son aquellos que se utilizan para halogenar alcanos (por ejemplo\(\ce{Cl_2}\)\(\ce{Br_2}\),\(\ce{SO_2Cl_2}\),, y N - bromoamidas; ver Secciones 4-4 y 14-3). Sin embargo, las características de los dos tipos de halogenación normalmente son muy diferentes. La 2-propanona ha sido particularmente bien estudiada, y las características importantes de la halogenación de este compuesto se resumen de la siguiente manera:
- La 2-propanona reacciona fácilmente con cloro, bromo y yodo.
- La 2-propanona reacciona a la misma velocidad con cada halógeno. De hecho, la tasa de formación de la 1-halo-2-propanona es independiente de la concentración del halógeno, incluso a concentraciones muy bajas de halógeno.
- La halogenación de 2-propanona es catalizada tanto por ácidos como por bases. Las expresiones de velocidad para la formación de 1-halo-2-propanona en solución acuosa son:
- a\(\ce{OH}^\ominus\) concentraciones moderadas
\[v = k \left[ \ce{CH_3COCH_3} \right] \left[ \ce{OH}^\ominus \right]\]
- a\(\ce{H}^\oplus\) concentraciones moderadas
\[v = k' \left[ \ce{CH_3COCH_3} \right] \left[ \ce{H}^\oplus \right]\]
La relación de\(k\) a\(k'\) es 12,000, lo que significa que el ion hidróxido es un catalizador mucho más efectivo que el ion hidrógeno.
El ion hidróxido es un catalizador mucho más efectivo que el ion hidrógeno
Para dar cuenta del papel de los catalizadores y la independencia de la velocidad de la concentración de halógeno, la cetona necesariamente debe ser convertida lentamente por los catalizadores en algo que pueda reaccionar rápidamente con el halógeno para dar los productos. Este algo es el enol o el anión enolato de la 2-propanona:
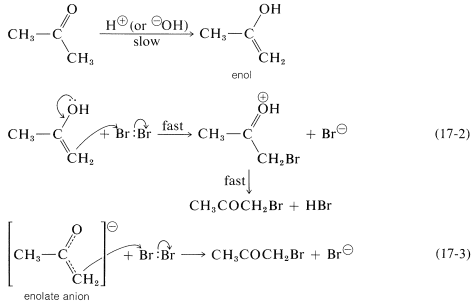
Siempre y cuando el primer paso sea lento en comparación con los pasos de las Ecuaciones 17-2 y 17-3, la velocidad global de reacción será independiente tanto de la concentración de halógeno como de si es cloro, bromo o yodo (ver Sección 4-4C).
La reacción del anión enol o enolato (Ecuaciones 17-2 o 17-3)\(\ce{Br_2}\) se asemeja al primer paso en la adición electrófila de halógenos a enlaces múltiples carbono-carbono (Sección 10-3A). Sin embargo, la segunda etapa, la adición del haluro nucleofílico, si ocurre en absoluto, no produce ningún producto estable:

Las cetonas asimétricas, como la 2-butanona, pueden formar dos enoles diferentes que reaccionarán con halógenos para dar halo cetonas isoméricas:

La composición de la mezcla de productos dependerá de las velocidades relativas de formación de los enoles isoméricos, siempre que la etapa de halogenación no sea una reacción reversible. Salvo efectos estéricos graves que influyan en la velocidad de reacción, el enol que se forma más rápidamente es generalmente el enol más estable termodinámicamente.
La reacción de haloforma
La discusión previa sobre la halogenación de cetonas es incompleta en un aspecto importante con respecto a la halogenación inducida por bases. Es decir, una vez que se forma una\(\alpha\) -halo cetona, los otros hidrógenos del mismo carbono se vuelven más ácidos por el efecto de atracción de electrones del halógeno y se reemplazan mucho más rápidamente que el primer hidrógeno:

El resultado es que, si se desea la monobromocetona, la reacción se lleva a cabo mejor con un catalizador ácido en lugar de un catalizador básico. Una complicación adicional en la halogenación catalizada por bases de una metil cetona es que la trihalocetona formada es atacada fácilmente por una base, dando como resultado de este modo la escisión de un enlace carbono-carbono:

Esta secuencia se denomina reacción haloforme porque da como resultado la producción de cloroformo, bromoforma o yodoforma, dependiendo del halógeno utilizado. La reacción haloforme es un método útil para la identificación de metilcetonas, particularmente cuando se usa yodo, ya que el yodoformo es un sólido altamente insoluble, de color amarillo brillante. La reacción también es muy efectiva para la síntesis de ácidos carboxílicos cuando la metil cetona está más disponible que el ácido correspondiente:

Debido a que la reacción haloforme es rápida, en algunos casos se puede utilizar para preparar ácidos insaturados a partir de cetonas insaturadas sin complicaciones graves causadas por la adición de halógeno al doble enlace:

Una reacción algo similar a la escisión de haloformas con hidróxido ocurre con cetonas que no tienen\(\alpha\) -hidrógenos a través de la acción de amida sódica:

Esta reacción, denominada reacción de Haller-Bauer, tiene utilidad para la preparación de amidas de los tipos\(\ce{ArCONH_2}\) y terc -\(\ce{RCONH_2}\), y, a través de hidrólisis, los correspondientes ácidos carboxílicos.
Reacciones de\(\alpha\) -Halo Cetonas
El halógeno de un\(\alpha\) -haloaldehído o una\(\alpha\) -halo cetona es excepcionalmente no reactivo en las reacciones de\(S_\text{N}1\) desplazamiento, pero es excepcionalmente reactivo en\(S_\text{N}2\) desplazamientos, en comparación con el halógeno de haluros de alquilo que tienen efectos estéricos potenciales comparables . Se observa un comportamiento similar con los ácidos\(\alpha\) -halocarboxílicos y se discute en el Capítulo 18.

En algunas circunstancias, la producción de un 2-haloalcohol por reducción del grupo carbonilo de una\(\alpha\) -halo cetona con hidruros metálicos es una reacción sintética útil:

Cuando se intentan\(E2\) reacciones con\(\alpha\) -halo cetonas usando bases fuertes como alcóxidos, puede ocurrir una interesante vía de reordenamiento llamada reordenamiento Favorskii. En esta reacción, la\(\alpha\) -halo cetona se convierte en un éster. Por ejemplo, la 2-clorociclohexanona se convierte en el éster metílico del ácido ciclopentanocarboxílico por tratamiento con metóxido de sodio en éter:

El mecanismo de esta reacción ha sido objeto de muchas investigaciones.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


