17.5: Sustitución Nucleofílica con Aniones Enolados
- Page ID
- 73540
Alquilación de Cetonas
La química sintética de los aniones enolados se centra en sus propiedades nucleofílicas y básicas. Por consiguiente, estos iones participan en\(S_\text{N}2\) reacciones con compuestos de alquilo adecuados:

Sin embargo, hay una serie de factores complicadores a considerar. En primer lugar, las condiciones básicas necesarias para formar los iones enolato a menudo conducen a reacciones secundarias como la adición de aldol y\(E2\) la eliminación de\(\ce{RX}\) compuestos. La adición de aldol se minimiza si el compuesto carbonilo es una cetona con una estructura desfavorable para la adición de aldol o si todo el compuesto carbonilo se convierte en su enolato. Para convertir todo un carbonilo simple en su enolato generalmente se requiere una base muy fuerte, como\(\ce{NH_2^+}\) en un disolvente aprótico o amoníaco líquido. Debido a que el anión enolato en sí mismo es una base fuerte, los mejores resultados se obtienen cuando el haluro\(\ce{RX}\),, no sufre\(E2\) reacciones fácilmente.
La segunda complicación surge si el compuesto alquílico reacciona tanto con carbono como con oxígeno del anión enolato nucleofílico. El producto de carbono es el resultado de la "\(\ce{C}\)-alquilación”, mientras que el producto de oxígeno es el resultado de la "\(\ce{O}\)-alquilación”:

La posibilidad de que el anión enolato actúe como si su carga estuviera efectivamente concentrada en carbono o en oxígeno se discutió previamente en relación con la adición de aldol (Sección 17-3B). Sin embargo, la situación allí era bastante diferente a la de aquí, porque la adición de aldol es fácilmente reversible, mientras que la alquilación no lo es. Además, aunque la reacción aldólica que implica la formación de\(\ce{C-O}\) enlaces es desfavorable\(\left( \Delta H^0 = + 20 \: \text{kcal mol}^{-1} \right)\) en comparación con la formación de\(\ce{C-C}\) enlaces\(\left( \Delta H^0 = - 4 \: \text{kcal mol}^{-1} \right)\), tanto\(\ce{O}\) - como\(\ce{C}\) -alquilación del anión tienen\(\Delta H^0 < 0\).
El predominio\(\ce{O}\) de la alquilación o la alquilación depende del control cinético (Sección 10-4A).\(\ce{C}\) No es sencillo predecir cuál de las dos posiciones del enolato será más nucleofílica, y de hecho, las mezclas de productos a menudo se obtienen en distribuciones que dependen del disolvente utilizado, la temperatura, la naturaleza y la naturaleza de la base empleada para formar el anión.\(\ce{X}\) \(\ce{O}\)-La alquilación tiende a ocurrir con cetonas de alto contenido enol (lo que generalmente significa que el anión enolato tendrá una densidad de carga especialmente alta sobre el oxígeno) y con agentes alquilantes que poseen un alto grado de\(S_\text{N}2\) reactividad.
Existe otra correlación que parece tener validez en muchas situaciones, al menos donde el control cinético es dominante; es decir, cuanto más libres (menos asociados) son los aniones ambientes de su catión, más probable es que el electrófilo ataque al átomo del anión con el carga negativa más alta. Por lo tanto, la\(\ce{O}\) alquilación del enolato de sodio de 2-propanona se ve favorecida en solventes apróticos que son buenos para solvatar cationes [como\(\ce{(CH_3)_2SO}\), Sección 8-7F].
En la alquilación de cetonas asimétricas es posible la formación de más de un anión enolato, y cuando esto ocurre, se obtienen mezclas de productos. Por lo tanto,

Sin embargo, cuando uno de los posibles aniones enolato está especialmente estabilizado, ya sea por conjugación o por grupos fuertes extractores de electrones, ese enolato suele ser la forma dominante y solo se forma un producto. Por lo tanto, la 2,4-pentandiona se metila en\(\ce{C3}\), no en\(\ce{C1}\):

Alquilación de enaminas
Las enaminas (Sección 16-4C), al igual que los aniones enolatos, tienen dos posiciones reactivas y, en principio, pueden dar ya sea\(\ce{N}\) - o\(\ce{C}\) -alquilación.

Ambos productos pueden formarse, pero se pueden separar fácilmente porque, en el tratamiento con ácido diluido, solo el producto de\(\ce{C}\) -alquilación se hidroliza a una cetona. Generalmente, la cetona alquilada es el producto deseado:

Por lo tanto, la alquilación de enaminas es una alternativa factible, y a veces mucho más útil, a la alquilación directa de cetonas porque procede bajo condiciones menos fuertemente básicas. La secuencia comienza con la conversión de una cetona en una enamina \(\overset{\ce{RNH_2}}{\longrightarrow}\)
\(\overset{\ce{RNH_2}}{\longrightarrow}\) \(+ \ce{H_2O}\),, seguido de\(\ce{C}\) -alquilación de la enamina
\(+ \ce{H_2O}\),, seguido de\(\ce{C}\) -alquilación de la enamina \(\overset{\ce{RX}}{\longrightarrow}\)
\(\overset{\ce{RX}}{\longrightarrow}\) \(+ \ce{X}^\ominus\), y termina con hidrólisis a la cetona alquilada,
\(+ \ce{X}^\ominus\), y termina con hidrólisis a la cetona alquilada, \(+ \ce{H_2O} \rightarrow\)
\(+ \ce{H_2O} \rightarrow\) \(+ \ce{R_2NH_2^-}\) . Un ejemplo típico del uso de enaminas para la alquilación de una cetona sigue:
\(+ \ce{R_2NH_2^-}\) . Un ejemplo típico del uso de enaminas para la alquilación de una cetona sigue:

Varias reacciones biológicas importantes utilizan intermedios de enamina como nucleófilos de carbono en reacciones\(\ce{C-C}\) formadoras de enlaces. Un ejemplo se discute en la Sección 17-3F.
Alquilación de carbaniones estabilizados con azufre
La química de los carbaniones estabilizados por grupos distintos de las funciones carbonilo es muy análoga a la química de los aniones enolatos. Hemos visto que la\(\ce{C-H}\) acidez de los compuestos con la característica estructural puede ser significativa (p\(K_\text{a}\) de 25 o menos) cuando\(\ce{X}\) es un átomo o grupo que puede deslocalizar efectivamente la carga negativa sobre el carbono en
puede ser significativa (p\(K_\text{a}\) de 25 o menos) cuando\(\ce{X}\) es un átomo o grupo que puede deslocalizar efectivamente la carga negativa sobre el carbono en . Los\(\ce{X}\) grupos típicos son\(\ce{C=O}\)\(\ce{C \equiv N}\),\(\ce{PR_3^+}\),\(\ce{SR_2^+}\),\(\ce{SO_2R}\), y\(\ce{SR}\). En consecuencia, podemos esperar que los carbaniones del tipo
. Los\(\ce{X}\) grupos típicos son\(\ce{C=O}\)\(\ce{C \equiv N}\),\(\ce{PR_3^+}\),\(\ce{SR_2^+}\),\(\ce{SO_2R}\), y\(\ce{SR}\). En consecuencia, podemos esperar que los carbaniones del tipo , cuando se forman, se asemejen a aniones enolatos y experimentarán reacciones de adición a\(\ce{C=O}\) y\(\ce{C=C}\), y serán alquilados con haluros de buena\(S_\text{N}2\) reactividad. De hecho, las reacciones de los iluros discutidas en la Sección 16-4A son ejemplos de la adición de carbaniones estabilizados con fósforo, azufre y nitrógeno a grupos carbonilo.
, cuando se forman, se asemejen a aniones enolatos y experimentarán reacciones de adición a\(\ce{C=O}\) y\(\ce{C=C}\), y serán alquilados con haluros de buena\(S_\text{N}2\) reactividad. De hecho, las reacciones de los iluros discutidas en la Sección 16-4A son ejemplos de la adición de carbaniones estabilizados con fósforo, azufre y nitrógeno a grupos carbonilo.
El azufre en sus estados de oxidación más altos (por ejemplo, sulfona\(\ce{-SO_2}-\)) es especialmente efectivo en la estabilización de centros de carbaniones adyacentes. Sin embargo, desde un punto de vista sintético existen desventajas para el agrupamiento de sulfona, ya que los carbaniones mejor estabilizados también son los menos reactivos, y la posterior eliminación del grupo sulfona puede ser difícil. Un buen equilibrio entre estabilidad carbaniónica, reactividad carbaniónica, y facilidad de escisión del\(\ce{C-S}\) enlace está presente en las estructuras\(\ce{RS-CH_2-SR}\) y . Esto se ilustra a continuación para un concepto sorprendentemente simple para preparar ciclobutanona, en el que los carbonos del anillo se derivan de metanal y 1,3-dibromopropano:
. Esto se ilustra a continuación para un concepto sorprendentemente simple para preparar ciclobutanona, en el que los carbonos del anillo se derivan de metanal y 1,3-dibromopropano:
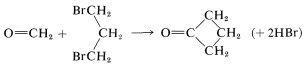
Para lograr esta síntesis, el metanal primero se convierte en un tiocetal, que luego se oxida parcialmente para dar\(13\). El tratamiento de\(13\) con una base fuerte lo convierte en el carbanión, que puede ser fácilmente alquilado. Mediante el uso de 1,3-dibromopropano y dos equivalentes de base, un doble desplazamiento forma el producto cíclico,\(14\). Los grupos azufre de se\(14\) pueden eliminar fácilmente por hidrólisis ácida para dar ciclobutanona:

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


