17.7: Cetenas
- Page ID
- 73564
Preparación de Cetenas
Las sustancias con dobles enlaces carbonilo y carbono-carbono acumulados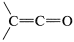 , se denominan cetenos y, como se puede esperar, tienen propiedades interesantes e inusuales. La propia cetena,\(\ce{CH_2=C=O}\), y sus productos de monosustitución,\(\ce{RCH=C=O}\) (\(\ce{R} =\)alquilo o arilo), se llaman aldocetenos, mientras que las cetenas disustituidas\(\ce{R_2C=C=O}\),, se llaman cetocetenos.
, se denominan cetenos y, como se puede esperar, tienen propiedades interesantes e inusuales. La propia cetena,\(\ce{CH_2=C=O}\), y sus productos de monosustitución,\(\ce{RCH=C=O}\) (\(\ce{R} =\)alquilo o arilo), se llaman aldocetenos, mientras que las cetenas disustituidas\(\ce{R_2C=C=O}\),, se llaman cetocetenos.
Existen relativamente pocos métodos generales para preparar cetenas. El procedimiento más sencillo es tratar un bromuro de\(\alpha\) -bromoacilo con zinc, pero los rendimientos generalmente no son muy buenos:

Varios métodos especiales están disponibles para la preparación de la propia cetena. La preparación de laboratorio más conveniente es pasar vapor de 2-propanona sobre una bobina de alambre de resistencia calentada eléctricamente a un calor rojo opaco; se excluye el aire para evitar una combustión simple:

Los enlaces más débiles son los\(\ce{C-C}\) enlaces y, en\(750^\text{o}\), la fragmentación produce un radical metilo y un radical etanoilo:

La transferencia de un átomo de hidrógeno (es decir, desproporción) da metano y cetena. Industrialmente, la cetena se prepara mejor por deshidratación del ácido etanoico:
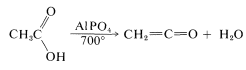
Reacciones de Ketenes
La cetena tiene un punto de ebullición\(-56^\text{o}\) y normalmente se almacenaría bajo presión en cilindros de acero. Sin embargo, esto no es posible porque la cetena es inestable con respecto a la formación de un dímero conocido como “dicetena”:

El dímero también es una sustancia altamente reactiva con características tan inusuales que su estructura no se estableció firmemente hasta 1956, casi 48 años después de que se preparó por primera vez.
Las cetenas en general son reactivos útiles para acilar alcoholes\(\ce{ROH}\), y aminas\(\ce{RNH_2}\), debido a que las reacciones implican adiciones; no hay subproductos a separar:

Las cetenas también se pueden utilizar para la síntesis de derivados de ciclobutano a través de [2 + 2] cicloadiciones con alquenos adecuadamente activos (Sección 13-3D):

La dicetena es muy útil en síntesis, particularmente a través de sus reacciones con alcoholes y aminas para dar derivados del ácido 3-oxobutanoico:

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


