18.2: Propiedades físicas de los ácidos carboxílicos
- Page ID
- 72887
Enlace de hidrógeno
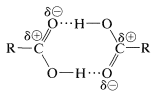
Los ácidos carboxílicos muestran un alto grado de asociación a través de enlaces de hidrógeno. Hemos encontrado tal unión previamente con alcoholes; sin embargo, los ácidos forman enlaces de hidrógeno más fuertes que los alcoholes debido a que sus\(\ce{O-H}\) enlaces están más fuertemente polarizados como\(\ce{-} \overset{\delta \ominus}{\ce{O}} \ce{-} \overset{\delta \oplus}{\ce{H}}\). Además, los ácidos carboxílicos son capaces de formar enlaces de hidrógeno al oxígeno negativo del dipolo carbonilo en lugar de solo al oxígeno de otro grupo hidroxilo. Los ácidos carboxílicos en los estados sólido y líquido existen principalmente como dímeros cíclicos, y estas estructuras diméricas persisten hasta cierto punto incluso en estado vapor y en solución diluida en disolventes hidrocarbonados:
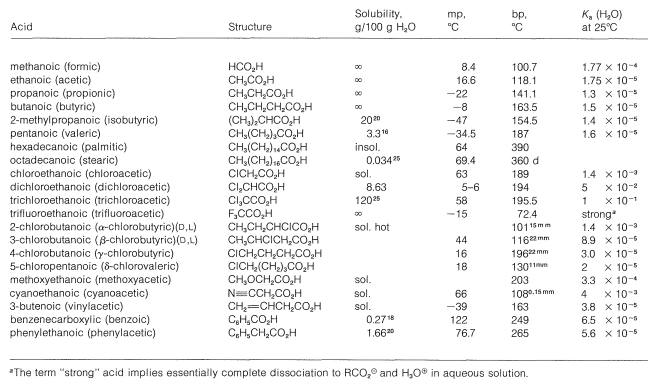
Cuadro 18-1: Propiedades físicas de los ácidos carboxílicos representativos
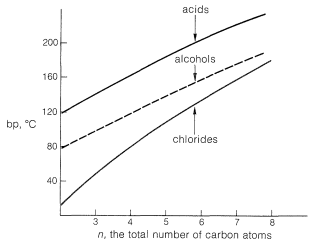
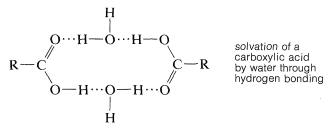
Los enlaces de hidrógeno también son responsables de la alta solubilidad en agua de los ácidos carboxílicos simples con menos de cinco carbonos; las moléculas de agua pueden solvatar el grupo carbonilo a través de enlaces de hidrógeno. Sin embargo, a medida que\(\ce{R}\) aumenta la longitud de la cadena del residuo hidrocarbonado, la solubilidad disminuye notablemente, debido a que la proporción de grupos polares a no polares se vuelve más pequeña.
Espectros de ácidos carboxílicos
Los espectros infrarrojos de los ácidos carboxílicos proporcionan evidencia clara de los enlaces de hidrógeno discutidos en la sección anterior. Esto se ilustra en la Figura 18-2, que muestra el espectro de ácido etanoico en solución de tetracloruro de carbono, junto con los de etanol y etanal para comparación.
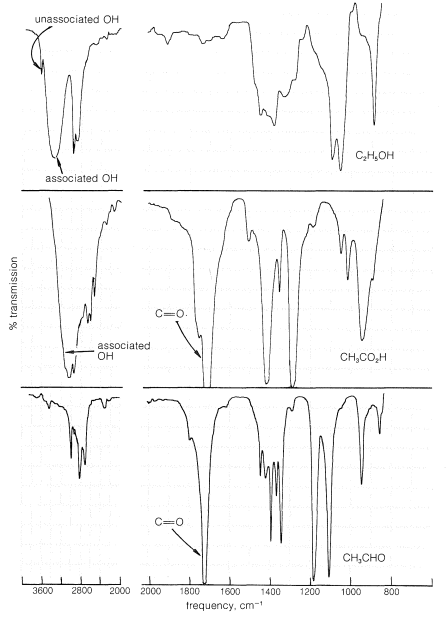
El espectro de etanol tiene dos bandas de absorción que son características del\(\ce{OH}\) enlace; una es una banda aguda en\(3640 \: \text{cm}^{-1}\), que corresponde a grupos hidroxilo libres o no asociados, y la otra es una banda ancha centrada en\(3350 \: \text{cm}^{-1}\) debido a grupos unidos a hidrógeno. El espectro de ácido etanoico no muestra absorción de grupos hidroxilo libres pero, al igual que el del etanol, tiene una absorción intensa muy amplia atribuida a\(\ce{OH}\) grupos asociados. Sin embargo, la frecuencia de absorción,\(3000 \: \text{cm}^{-1}\), se desplaza apreciablemente de la del etanol y refleja enlaces de hidrógeno más fuertes que en el etanol. La absorción debida al grupo carbonilo del ácido etanoico\(\left( 1740 \: \text{cm}^{-1} \right)\) es amplia, pero se encuentra aproximadamente en la misma posición que la absorción de carbonilo en etanal.
La función carboxilo absorbe la radiación ultravioleta, pero las longitudes de onda a las que esto ocurre son apreciablemente más cortas que para los compuestos carbonílicos como aldehídos y cetonas, y, de hecho, están fuera del rango de la mayoría de los espectrómetros ultravioleta comerciales. Alguna idea de cómo el sustituyente hidroxilo modifica las propiedades de absorción del grupo carbonilo en ácidos carboxílicos se puede observar en la Tabla 18-2, en la que se listan las longitudes de onda de máxima absorción de luz\(\left( \lambda_\text{max} \right)\) y los coeficientes de extinción a la absorción máxima\(\left( \epsilon_\text{max} \right)\) de varios carboxílicos ácidos, aldehídos y cetonas.
Cuadro 18-2: Longitudes de onda para la máxima absorción ultravioleta de algunos ácidos carboxílicos, aldehídos y cetonas\(\left( n \rightarrow \pi^* \right)\)

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


