18.4: Reacciones en el Carbono Carbonílico de Ácidos Carboxílicos
- Page ID
- 72910
Muchas reacciones importantes de los ácidos carboxílicos implican el ataque al carbono del grupo carbonilo por especies nucleofílicas. Estas reacciones frecuentemente son catalizadas por ácidos, debido a que la adición de un protón o formación de un enlace de hidrógeno al oxígeno carbonilo hace que el carbono carbonilo sea más vulnerable al ataque nucleofílico. Las siguientes ecuaciones ilustran cómo opera una reacción catalizada por ácido con un nucleófilo neutro\(\left( \ce{H-Nu} \right)\):
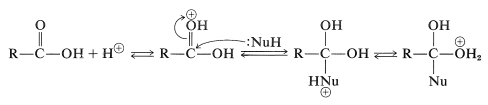
La escisión posterior de un\(\ce{C-O}\) enlace y la pérdida de un protón producen un producto de desplazamiento:
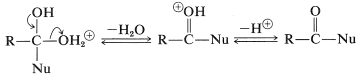
Un ejemplo importante de este tipo de reacción es la formación de ésteres, la cual se discutió previamente en relación con las reacciones de los alcoholes en la Sección 15-4D. Mecanismos similares de adición-eliminación ocurren en muchas reacciones en los grupos carbonilo de los derivados ácidos. Un ejemplo menos obvio de adición a grupos carboxilo implica el ion hidruro\(\left( \ce{H}^\ominus \right)\) y tiene lugar en la reducción de hidruro de litio y aluminio de ácidos carboxílicos (Secciones 16-4E y 18-3C).
Esterificación
Los ésteres\(\ce{RCO_2R'}\),, se forman a partir de ácidos carboxílicos y alcoholes en presencia de catalizadores ácidos. El paso clave en la esterificación es el ataque nucleofílico de una molécula de alcohol neutro\(\ce{R'OH}\), en el carbono carbonilo del ácido conjugado del ácido carboxílico,\(\ce{RC(OH)_2^+}\),\(6\):
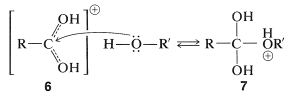
El intermedio\(7\), o bien puede volver a los materiales de partida o formar un segundo intermedio,\(8\), por transferencia de protones. Pérdida de agua de los\(8\) cables al ácido conjugado del éster,\(9\):
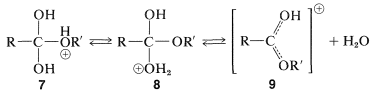
La etapa final en la formación del éster es la transferencia de protones desde\(9\) el disolvente:
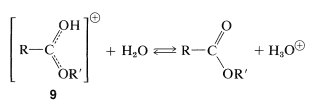
Todos los pasos en la formación del éster son reversibles, pero el\(\ce{C-O}\) equilibrio en los procesos de formación de enlaces y ruptura no son muy favorables, y se requiere un exceso de un reactivo (generalmente el alcohol) o la eliminación de un producto (la mayoría de las veces agua) para dar un buen rendimiento de éster.
La utilidad de la formación directa de ésteres a partir de alcoholes y ácidos se limita a aquellos alcoholes o ácidos que no experimentan reacciones secundarias extensas en presencia de ácidos fuertes. Además, si el alcohol es particularmente voluminoso, la reacción normalmente no procederá satisfactoriamente porque los intermedios\(7\) y\(8\) (así como el producto) se vuelven inestables por el agrupamiento de los grupos sustituyentes.
Los grupos voluminosos en el ácido esterificante también dificultan la reacción. Un ejemplo clásico es el ácido 2,4,6-trimetilbenzoico (mesitoico), que no se puede esterificar fácilmente en condiciones normales debido a que los grupos metilo orto con respecto al grupo carboxilo hacen que el estado de transición para la formación del intermedio sea\(10\) menos favorable en relación con el ácido de partida que sería el caso de ácidos menos impedidos, como el ácido etanoico:
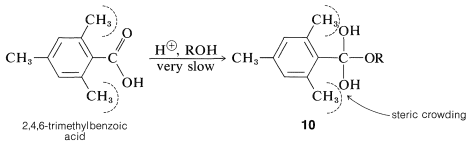
El punto importante es la diferencia en el impedimento estérico entre el ácido y el intermedio. Si haces un modelo a escala verás que en el ácido, el grupo carboxilo, al ser plano, puede tener un impedimento reducido al girar alrededor de su enlace al anillo para estar entre los grupos metilo. Sin embargo, no es posible tal relieve con\(10\), en el que el\(\ce{-C(OH)_2OR}\) carbono es tetraédrico.
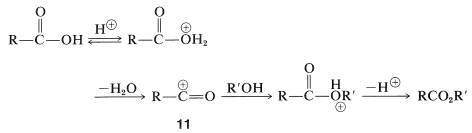
La esterificación de ácidos con sustituyentes voluminosos, como el ácido 2,4,6-trimetilbenzoico, se puede lograr mediante la formación de cationes acilo. Esto se hace simplemente disolviendo el ácido carboxílico en ácido sulfúrico fuerte, con lo que\(11\) se forma el catión acilo, y luego vertiendo la solución en un exceso de alcohol frío (ver también Ecuaciones 18-5 y 18-6). Este procedimiento funciona porque evita la formación de un intermedio tetraédrico impedido similar\(10\) y en su lugar forma el ácido conjugado directamente:
La esterificación de ácidos carboxílicos con alcoholes voluminosos es insatisfactoria. Sin embargo, los ésteres alquílicos terciarios a menudo se pueden preparar mediante la adición del ácido al alqueno apropiado usando un catalizador ácido:

El éxito de tales reacciones de adición depende de la formación de un carbocatión estable a partir del alqueno en condiciones donde el nucleófilo más reactivo presente es el ácido carboxílico.
Formación de cloruro de acilo
Los ácidos carboxílicos reaccionan con tricloruro de fósforo, pentacloruro de fósforo o cloruro de tionilo con reemplazo de\(\ce{OH}\) by\(\ce{Cl}\) para formar cloruros de acilo,\(\ce{RCOCl}\):
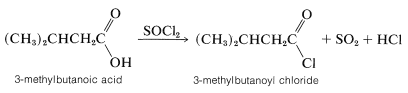
Si bien no se han establecido mecanismos detallados, se piensa que el primer paso es la formación de un anhídrido mixto inestable, que luego se extruye\(\ce{SO_2}\) y “colapsa” con la unión de cloruro en el carbono carbonílico. Un mecanismo similar ocurre en la formación de cloruros de alquilo a partir de alcoholes y cloruro de tionilo (Sección 15-5A):
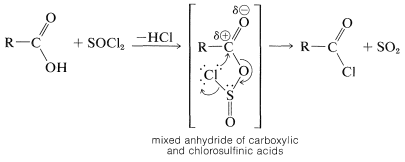
La mayoría de los haluros de acilo son líquidos estables y destilables. Sin embargo, el cloruro de metanoilo\(\ce{HCOCl}\),, se descompone en monóxido de carbono y cloruro de hidrógeno a temperatura ambiente.
Reducción de Ácidos Carboxílicos
Generalmente, los ácidos carboxílicos son difíciles de reducir ya sea por hidrogenación catalítica o por sodio y alcohol. No obstante, la reducción a alcoholes primarios procede suavemente con hidruro de litio y aluminio,\(\ce{LiAlH_4}\):
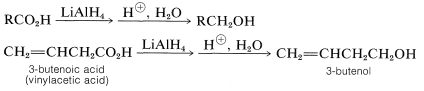
El primer paso en la reducción con hidruro de litio y aluminio de ácidos carboxílicos es la formación de una sal de aluminio compleja del ácido e hidrógeno:
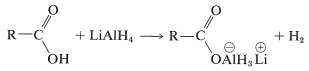
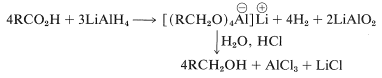
La reducción entonces procede por transferencias sucesivas de ion hidruro, (\ ce {H} ^\ ominus\), del aluminio al carbono. La primera transferencia de este tipo reduce la sal ácida al nivel de oxidación del aldehído; la reducción no se detiene en este punto, sin embargo, sino que continúa rápidamente al alcohol. No se dispone de información suficiente para permitir que se escriban estructuras muy específicas para los intermedios en la reducción de ácidos carboxílicos con hidruro de litio y aluminio. Sin embargo, el producto es un alcóxido de aluminio complejo, del cual se libera el alcohol por hidrólisis:
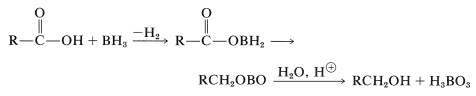
El borohidruro de sodio\(\ce{NaBH_4}\),, es un agente reductor demasiado suave para transferir hidruro a ácidos carboxílicos, y uno puede sospechar que el borano\(\ce{BH_3}\),, también sería ineficaz. Sin embargo, este no es el caso y el borano en oxaciclopentano (tetrahidrofurano) reduce los ácidos carboxílicos más rápidamente de lo que agrega a los dobles enlaces alquenos (ver Tale 16-5):
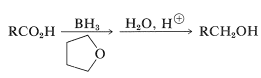
La razón de la alta reactividad radica en el hecho de que el ácido primero convierte el borano en un aciloxiborano, que luego sufre un reordenamiento intramolecular en el que se reduce el grupo carbonilo. La hidrólisis da al alcohol:
Se requieren métodos especiales para la reducción directa de\(\ce{RCO_2H}\) a\(\ce{RCHO}\). Los aldehídos se pueden obtener directamente por la lenta reducción de ácidos carboxílicos con 2,3-dimetil-2-butilborano en solución de oxaciclopentano. Un hidrógeno del borano se desperdicia a través de la reacción con el hidrógeno ácido del grupo carboxilo para dar hidrógeno. Un ejemplo es

El borano se prepara mediante la adición de 2,3-dimetil-2-buteno y, debido\(\ce{B_2H_6}\) al impedimento estérico, solo se forma el monoalquilborano (Sección 11-6A):

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


