18.8: Reacciones en el Carbono Carbonílico de Derivados Acidos
- Page ID
- 72915
Reacciones de desplazamiento
La hidrólisis de la mayoría de los derivados ácidos a los ácidos parentales está catalizada por ácido o base:
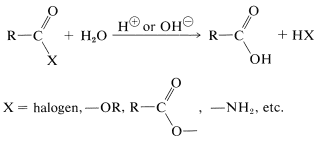
Sin embargo, los haluros y anhidridos de acilo generalmente se hidrolizan rápidamente sin la ayuda de un catalizador ácido o básico, cuando están en solución. Es importante reconocer que un haluro o anhídrido de acilo insoluble a menudo reacciona lentamente con el agua. Los ésteres y amidas se hidrolizan mucho más lentamente, y para tasas útiles requieren un catalizador. La hidrólisis de amidas es de importancia excepcional en bioquímica y se discutirá con más detalle en los Capítulos 24 y 25.
La hidrólisis catalizada por ácido de ésteres es la inversa de la formación de ésteres catalizada por ácido discutida anteriormente. La hidrólisis de éster inducida por bases (saponificación) es una reacción irreversible. La etapa inicial es el ataque del ion hidróxido en el carbono carbonilo:
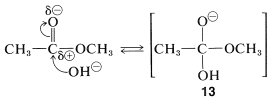
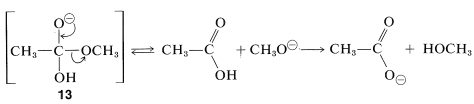
El anión intermedio\(13\), así formado entonces pierde\(\ce{OH}^\ominus\) y vuelve al éster original, o pierde\(\ce{CH_3O}^\ominus\) para formar el ácido. La reacción global es irreversible porque una vez que se forma el ácido, inmediatamente se convierte en el anión carboxilato, el cual se estabiliza a tal grado que no es atacado por el alcohol y no va a reformar el éster de partida. En consecuencia, la reacción va a completarse en la dirección de la hidrólisis:
El intercambio de ésteres está estrechamente relacionado con la hidrólisis de ésteres. Esta es una reacción catalizada por bases que es útil para reemplazar el grupo alcohol de un éster con un grupo alcohol diferente. El catalizador es ion alcóxido y la constante de equilibrio es cercana a la unidad, a menos que los alcoholes difieran mucho en tamaño. Un ejemplo es

en el que\(\ce{RO}^\ominus\) se encuentra\(\ce{CH_3O}^\ominus\) o\(\ce{CH_3CH_2O}^\ominus\).
Se ha discutido la formación de ésteres a partir de cloruros y anhidridos de ácido de acuerdo con la siguiente ecuación:
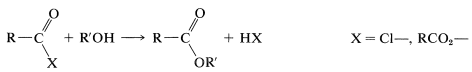
Las amidas se pueden obtener a partir de haluros de acilo, anhidridos carboxílicos o ésteres con aminas o amoníaco. Los mecanismos de estas reacciones son muy similares a las reacciones correspondientes de los alcoholes:
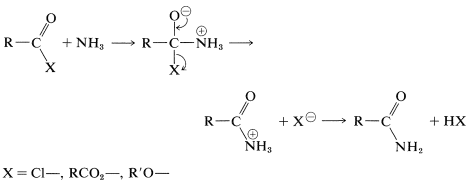
Discutiremos más a fondo este tipo de reacciones en los Capítulos 24 y 25.
Reacciones con Compuestos Organometálicos
Las reacciones de varios derivados de ácido carboxílico con compuestos de organomagnesio y organolitio se describieron en la Sección 14-12. El paso clave en estas reacciones es la adición del compuesto organometálico, como\(\ce{R}^{\delta \ominus} \ce{M}^{\delta \oplus}\), al grupo carbonilo. Para un reactivo de Grignard,
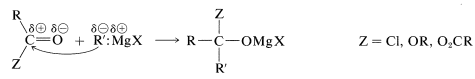
La reacción normalmente no se detiene en esta etapa;\(\ce{MgXZ}\) se elimina y la cetona resultante reacciona rápidamente con otra molécula de compuesto organometálico. En la hidrólisis, se forma un alcohol terciario con al menos dos grupos alquilo idénticos en el carbono terciario:
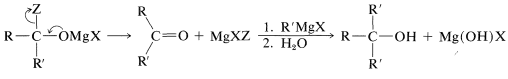
Reducción de Derivados de Ácido
Los ésteres, cloruros y anhidridos son reducidos por hidruro de litio y aluminio de la misma manera general que los ácidos progenitores (Sección 18-3C), la diferencia es que no se desprende hidrógeno. Los productos después de la hidrólisis son alcoholes primarios:
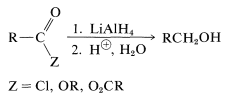
Los nitrilos se pueden reducir a aminas mediante hidruro de litio y aluminio. Una sal imina es un producto intermedio; si la reacción se lleva a cabo en las condiciones adecuadas, esta sal es el producto principal y proporciona un aldehído en la hidrólisis (ver Sección 16-4C):
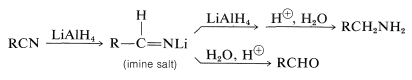
Las amidas se reducen a aminas primarias, y las amidas\(\ce{N}\) sustituidas a aminas secundarias y terciarias:
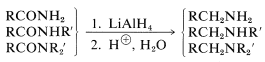
El borano también reducirá los ésteres, amidas y nitrilos a los mismos productos que lo hace\(\ce{LiAlH_4}\), pero con reactividad reducida (Cuadro 16-6).
Aunque el hidruro de litio y aluminio y los boranos son reactivos muy útiles, son caros y poco prácticos de emplear a gran escala. Entonces pueden ser necesarios otros métodos de reducción. De estos, los más importantes son la reducción de ésteres con sodio y etanol (los ácidos no reaccionan fácilmente),
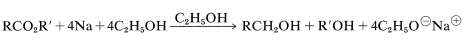
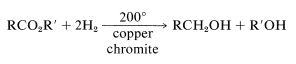
e hidrogenación a alta presión sobre un catalizador de cromita de cobre,
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


