21.5: Aplicación del Método MO al 1,3-Butadieno
- Page ID
- 72831
Para tratar el sistema\(\pi\) -electrón del 1,3-butadieno mediante la teoría simple de MO, combinamos los cuatro orbitales de\(p\) carbono de un modelo atómico-orbital, tal como\(17\), para obtener cuatro orbitales moleculares:
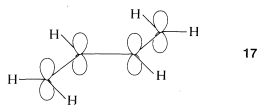
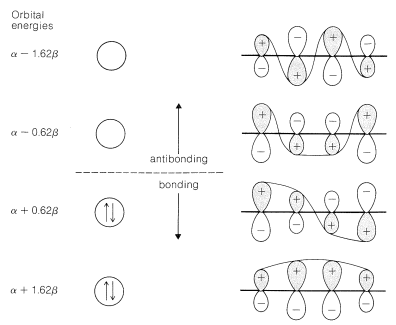
Podemos estimar una energía de estabilización para butadieno a partir de calores de hidrogenación, y es útil comparar los valores obtenidos con la energía de deslocalización calculada. Así es el calor de hidrogenación del 1,3-butadieno\(57.1 \: \text{kcal}\), mientras que el del eteno es\(32.8 \: \text{kcal}\) y del propeno\(30.1 \: \text{kcal}\). Si se usa eteno como alqueno modelo, la energía de estabilización del 1,3-butadieno es\(\left( 2 \times 32.8 - 57.1 \right) = 8.5 \: \text{kcal}\), mientras que con propeno como modelo, lo sería\(\left( 2 \times 30.1 - 57.1 \right) = 3.1 \: \text{kcal}\). Las energías de enlace (Cuadro 4-3) en combinación con el calor de formación\(25^\text{o}\)\(\left( 26.33 \: \text{kcal} \right)\) dan una energía de estabilización de\(5.0 \: \text{kcal}\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


