21.8: Más sobre energías de estabilización
- Page ID
- 72852
Se demostró en la Sección 21-3 que el benceno es\(36\)\(38 \: \text{kcal}\) -más estable que la molécula hipotética 1,3,5-ciclohexatrieno sobre la base de las diferencias entre calores experimentales de combustión, o hidrogenación, y calores calculados a partir de energías de enlace. Llamamos a esta diferencia energética la energía de estabilización (SE) del benceno. Hemos asociado la mayor parte de esta diferencia de energía con la deslocalización de\(\pi\) electrones, que es la energía de deslocalización (DE). La diferencia entre SE y DE será pequeña solo si nuestras tablas de energía de unión son confiables y los efectos estéricos y de deformación son pequeños.
El problema con las energías de enlace es que utilizamos energías de enlace que descuidan los cambios en la fuerza de unión causados por el medio ambiente. Se supone que los\(\ce{C_H}\) enlaces primarios, secundarios, terciarios, alquénicos y alquínicos tienen las mismas energías; se supone que los enlaces\(\ce{C-C}\) simples son iguales, independientemente de si los otros enlaces a los átomos de carbono en cuestión son simples o múltiples; y diferencias en se descuida la energía entre dobles enlaces que son mono-, di-, tri- o tetra-sustituidos, así como los cambios en las energías de enlace asociadas con la cepa estérica. Las energías de enlace son estrictamente aplicables a moléculas en las que los enlaces son de longitudes normales. En el caso del benceno, que tiene\(\ce{C-C}\) enlaces con longitudes intermedias entre los enlaces simples y dobles normales, no parece haber un acuerdo claro en cuanto a cómo tomar en cuenta las distancias de los enlaces en el cálculo de la energía de deslocalización. A pesar de estas incertidumbres, las energías de estabilización parecen dar una buena idea cualitativa de la importancia de la deslocalización electrónica en las moléculas orgánicas.
Los cuadros 21-1 y 21-2 dan energías de estabilización para varias sustancias que mejor se representan como estructuras híbridas.
Tabla 21-1: Energías de estabilización (o energías de deslocalización aproximadas) a partir de calores de formación de algunos compuestos aromáticos
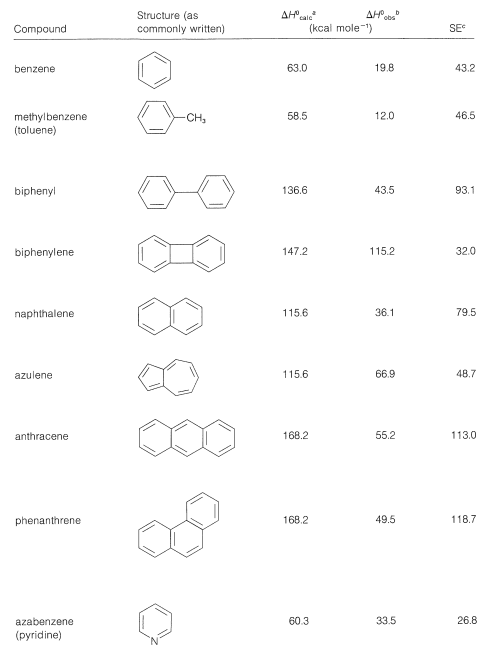

Cuadro 21-2: Energías de Estabilización (SE) de Calores de Formación\(\left( \Delta H^0 \right)\) de Algunos Polienos Conjugados

Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


