21.10: Regla 4n + 2 de Hückel
- Page ID
- 72808
Ciclobutadieno y ciclooctatetraeno
Hace más de 100 años, Kekule reconoció la posible existencia de otros polialquenos cíclicos conjugados, que al menos superficialmente se esperaría que tuvieran propiedades como el benceno. Los más interesantes de estos son el ciclobutadieno\(23\), y el ciclooctatetraeno,\(24\):
Para cada uno podemos escribir dos estructuras VB planas equivalentes, y el método VB cualitativo sugeriría que ambos compuestos, como el benceno, tienen energías sustanciales de deslocalización de electrones. Sin embargo, las estructuras planas tendrían\(\ce{C-C=C}\) ángulos anormales, y consecuentemente al menos algún grado de desestabilización asociado con estos ángulos de unión (Sección 12-7). Sin embargo, la estimación de las energías de deformación muestra que si bien son sustanciales, no son prohibitivas. ¿Deberían entonces estabilizarse estas moléculas por resonancia en el mismo sentido que se postula que es el benceno?
En 1911 un químico alemán, R. Willstatter (Premio Nobel 1915), reportó una extraordinaria síntesis de trece pasos de ciclooctatetraeno a partir de un alcaloide raro llamado pseudopelletierina aislado de la corteza de los granados. Se reportó que el producto era un compuesto altamente insaturado de color amarillo claro que absorbió cuatro moles de hidrógeno para formar ciclooctano. Numerosos intentos de repetir la síntesis de Willstatter no tuvieron éxito, y en la década de 1930 la opinión predominante era que el producto había sido identificado mal. Sin embargo, durante la Segunda Guerra Mundial, el químico alemán W. Reppe encontró que el ciclooctatetraeno puede hacerse en rendimientos razonables por la tetramerización de etino bajo la influencia de un catalizador de cianuro de níquel:

Las propiedades del producto corroboraron los reportes de Willstatter y quedó claro que el ciclooctatetraeno no es como el benceno.
Estudios posteriores de la geometría de la molécula revelaron además que es no planar, con enlaces simples y dobles alternantes,\(25a\):
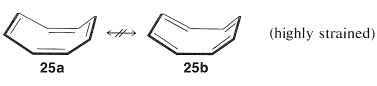
Esta geometría excluye la posibilidad de dos estructuras VB equivalentes, como para el benceno, ya que, como verás si intentas hacer un modelo de bola y palo,\(25b\) es altamente tensa y no energéticamente equivalente a\(25a\) en absoluto. Así podemos concluir que la energía de deslocalización del ciclooctatetraeno no es lo suficientemente grande como para superar la tensión angular que se desarrollaría si la molécula se volviera plana y permitiera que los\(\pi\) electrones formen\(\pi\) enlaces equivalentes entre todos los pares de carbonos adyacentes.
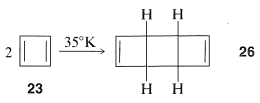
Ciclobutadieno\(23\),, eludió a Kekule, Willstatter, y una gran cantidad de otros investigadores durante casi 100 años. A medida que se hacía más trabajo, se hizo cada vez más claro que la molécula, cuando se formaba en reacciones, se convertía inmediatamente en otra cosa. Finalmente, el will-o'-the-wisp fue capturado en una matriz esencialmente rígida de argón en\(8 \: \text{K}\). Se caracterizó por sus propiedades espectrales (no por análisis de combustión). Al calentarse hasta igualar\(35 \: \text{K}\), dimeriza para dar\(26\):
Una posibilidad para la falta de estabilidad\(^4\) del ciclobutadieno es que la deformación angular asociada con tener cuatro\(sp^2\) carbonos en un anillo de cuatro miembros es mucho mayor de lo estimado. Sin embargo, la existencia estable de muchos compuestos con cuatro de tales\(sp^2\) carbonos, por ejemplo\(27\) y\(28\), hacen que este argumento sea débil, si no inválido:
¿Por qué, entonces, el ciclobutadieno es tan inestable y reactivo? En este punto, y también con respecto al carácter no aromático del ciclooctatetraeno, el método VB cualitativo simple que hemos esbozado no ayuda en absoluto. No hay manera simplemente de mirar los esquemas de apareamiento de electrones\(23\)\(24\) y ver alguna diferencia entre ellos y los esquemas correspondientes para el benceno. \(^5\)
Es en esta área donde los procedimientos de MO cualitativos tienen un gran éxito debido a que existen características generales de los orbitales\(\pi\) moleculares de sistemas monocíclicos de polieno conjugado que predicen diferencias en las propiedades del ciclobutadieno, benceno, ciclooctatetraeno y otros compuestos similares que no son obvios por el sencillo método VB.
Como regla general, para\(p\) los orbitales atómicos\(N\) paralelos que se superponen de la\(\pi\) manera en una matriz monocíclica, solo habrá un orbital molecular más bajo, teniendo todos los orbitales atómicos la misma fase. Esto se verá para el benceno en la Figura 21-5. Lo que es más difícil de entender sin pasar por los cálculos es que se predice que los orbitales moleculares de mayor energía para los polienos conjugados cíclicos vendrán en\(^6\) pares degenerados sucesivos, como se muestra en la Figura 21-13 para\(N = 3\) a\(9\).
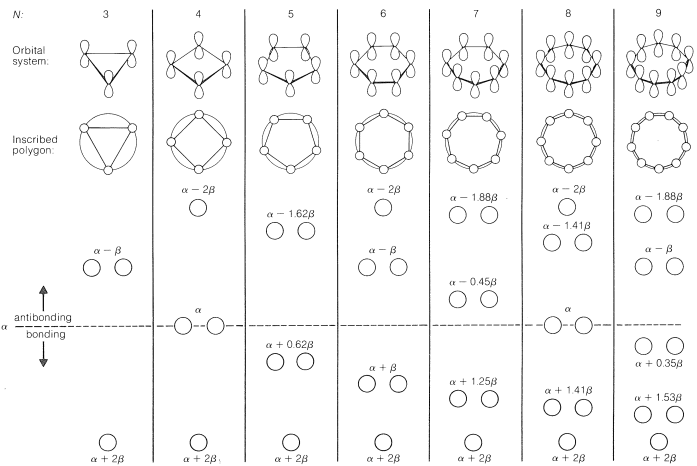
El ordenamiento cualitativo y, de hecho, los valores numéricos de las energías de los orbitales\(\pi\) moleculares para un sistema cíclico de\(N\)\(p\) orbitales se pueden derivar de una manera muy sencilla. Solo es necesario inscribir un polígono regular con\(N\) lados dentro de un círculo de radio\(2 \beta\) con una esquina hacia abajo. Por ejemplo, para\(N = 5\) obtenemos lo siguiente:
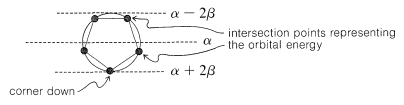
Las energías orbitales moleculares se encuentran en unidades de\(\beta\) en las esquinas del polígono. El nivel de no unión corresponde a la línea discontinua horizontal trazada a través del centro del círculo.
Los datos de la Figura 21-13 proporcionan una justificación para la inestabilidad de ciclobutadieno y ciclooctatetraeno. Para el ciclobutadieno, podemos calcular que cuatro\(\pi\) electrones en los orbitales más bajos conducirán a una energía predicha de\(\pi\) electrones de\(2 \left( \alpha + 2 \beta \right) + 2 \left( \alpha \right) = 4 \alpha + 4 \beta\), que es solo la energía\(\pi\) -electrónica calculada para dos enlaces eteno (ver Figura 21-3). ¡Por lo tanto, se predice que la energía de deslocalización de los\(\pi\) electrones del ciclobutadieno será cero!
Otra característica del\(\pi\) sistema de ciclobutadieno es que los cuatro\(\pi\) electrones no bastan para llenar los tres orbitales más bajos y, si aplicamos la regla de Hund (Sección 6-1), la mejor manera de disponer los electrones es como en\(29\), con dos electrones desapareados, que se conoce como un estado triplete:\(^7\)
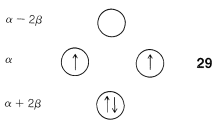
Con las predicciones MO de energía de deslocalización cero y una configuración electrónica con electrones desapareados, no debemos sorprendernos que el ciclobutadieno dimeriza fácilmente para dar\(26\) incluso a temperaturas muy bajas.
Las energías de los orbitales moleculares calculadas para ciclooctatetraeno plano (Figura 21-13) conducen a una energía de deslocalización predicha de\(\left( 8 \alpha + 9.64 \beta \right) - \left( 8 \alpha + 8 \beta \right) = 1.64 \beta\)\(\left( \sim 31 \: \text{kcal} \right)\), que es menor que la del benceno, a pesar de que hay ocho orbitales atómicos en lugar de seis a través de los cuales los electrones son deslocalizado. Además, la configuración electrónica más baja para la molécula plana es, como el ciclobutadieno, que se predice que es un triplete. La evidencia experimental indica que las posiciones de los dobles enlaces del ciclooctatetraeno se desplazan lentamente como resultado de la formación de la molécula en el estado plano inestable. El aporte de energía requerido para aplanar la molécula es de aproximadamente\(15 \: \text{kcal mol}^{-1}\):
Según lo formuló Huckel, la\(4n + 2\) regla se aplica únicamente a los sistemas monocíclicos. Sin embargo, como cuestión práctica se puede utilizar para predecir las propiedades de los polienos conjugados policíclicos, siempre que las importantes estructuras VB involucren solo los dobles enlaces perimetrales, como en los siguientes ejemplos:
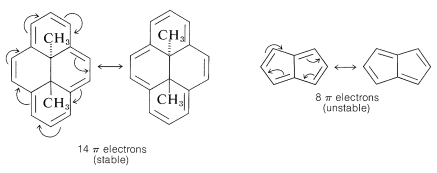
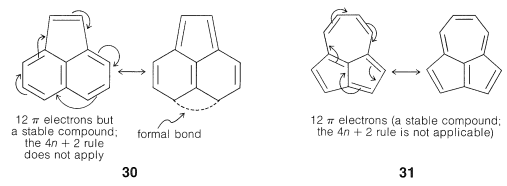
La aplicación de la\(4n + 2\) regla a otros\(\pi\) sistemas, como\(30\) y\(31\), no es válida porque no se pueden escribir buenas estructuras VB que impliquen cambios en los esquemas de emparejamiento de los electrones perimetrales todos a la vez.
Aplicación de la Resonancia y de la\(4n + 2\) Regla a Iones Cíclicos
Los hidrógenos del\(\ce{-CH_2}-\) grupo de 1,3-ciclopentadieno son ácidos. De hecho, son considerablemente más ácidos que los hidrógenos etinos de los 1-alquinos (Sección 11-8). Esto significa que el 1,3-ciclopentadieno es al menos\(10^{30}\) veces más ácido que los alcanos ordinarios. La razón es que la pérdida de uno de los\(\ce{CH_2}\) protones del ciclopentadieno da como resultado la formación de un anión especialmente estabilizado:
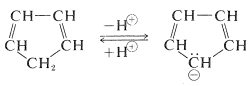
La estructura del anión puede describirse como un híbrido de cinco estructuras energéticamente equivalentes,\(34a\) hasta (34e). Por lo tanto, el par de electrones no compartidos se deslocaliza sobre cinco átomos de carbono, y el anión deslocalizado resultante es mucho más estable de lo esperado para cualquiera de las estructuras localizadas equivalentes:
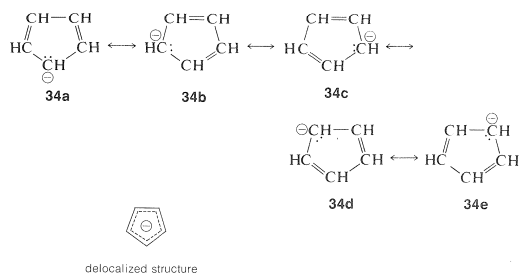
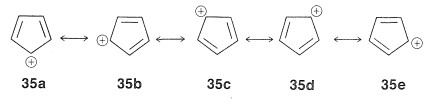
Esto parece muy razonable, aunque la belleza simple es aparentemente destruida por el hecho de que el catión ciclopentadienilo no es muy estable, a pesar de las cinco estructuras,\(35a\) a través de\(35e\), que se pueden escribir para ello:
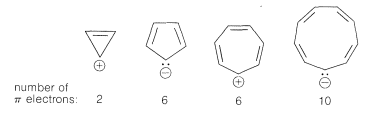
La extensión de estas ideas a los otros tamaños de anillo de la Figura 21-13 sugiere que todos los siguientes iones, que tienen\(\left( 4n + 2 \right)\)\(\pi\) electrones, deberían ser inusualmente estables:
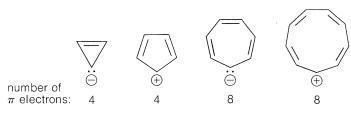
En contraste, los siguientes deben ser inestables con\(4n\)\(\pi\) electrones y configuraciones electrónicas de tripletes:
Estas predicciones, de hecho, están sustentadas por muchos experimentos, algunos de los cuales discutiremos más adelante.
\(^4\)Debe reconocerse que el término “estabilidad” está sujeto a muchas interpretaciones. Un criterio de estabilidad sería si una molécula aislada se fragmentaría espontáneamente en el espacio interestelar, tal como cabría esperar de una “molécula” compuesta por dos átomos de neón\(1.5 \: \text{Å}\) separados (ver Figura 4-6). Un criterio diferente sería si una molécula podría conservarse en presencia de la misma u otra clase de moléculas a alguna temperatura especificada. El criterio clásico sería si la sustancia podría aislarse, colocarse en una botella y conservarse por lo menos por poco tiempo. Toda la evidencia existente indica que las moléculas de ciclobutadieno no se descompondrían espontáneamente en el espacio interestelar, sino que reaccionan entre sí extremadamente fácilmente, incluso a bajas temperaturas, y solo pueden conservarse mantenidas aisladas unas de otras en una matriz rígida de un material muy inerte, tales como argón sólido. La “estabilidad” en el sentido de “falta de reactividad” tiene que definirse cuidadosamente en términos de condiciones experimentales. Por ejemplo,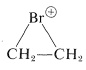 es muy inestable en presencia de nucleófilos como el agua o el metanol, mientras que es bastante estable en “soluciones superácidas” donde no hay buenos nucleófilos presentes (Sección 10-3B).
es muy inestable en presencia de nucleófilos como el agua o el metanol, mientras que es bastante estable en “soluciones superácidas” donde no hay buenos nucleófilos presentes (Sección 10-3B).
\(^5\)Una extensión bastante simple del método VB por lo que se llama el “principio de continuidad de fase orbital” sí permite el juicio cualitativo de que el ciclobutadieno debería ser menos estable que el benceno [ver W. A. Goddard III, J. Amer. Chem. Soc. 94, 743 (1972), para aplicaciones a muchos procesos para los que la teoría VB generalmente ha sido considerada como incapaz de dar mucha perspicacia].
\(^6\)Los orbitales degenerados tienen la misma energía; ver Sección 6-1.
\(^7\)Se usa el nombre “estado triplete” porque un sistema con dos electrones desapareados tiene tres estados de energía diferentes en un campo magnético.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


