21.11: Reacciones Pericíclicas
- Page ID
- 72862
¿Por qué las [4 + 2] y [2 + 2] son diferentes las cicloadiciones?
Existen numerosas reacciones en la química orgánica que proceden a través de estados de transición cíclicos. Pueden clasificarse generalmente como reacciones pericíclicas. Un ejemplo importante y familiar es la reacción de Diels-Alder, en la que un dieno conjugado cicloagrega a un alqueno o alquino:
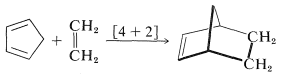
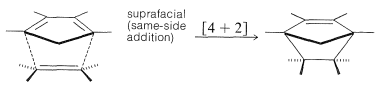
Esta reacción ha sido descrita previamente (Sección 13-3A) y es un ejemplo de una cicloadición [4 + 2]. Tales reacciones ocurren térmicamente (simplemente calentando los reactivos) y parecen estar completamente concertadas. Con esto queremos decir que los reactivos se convierten en productos en una sola etapa, sin implicar la formación de intermedios de reacción. La principal evidencia de la concertación de [4 + 2] cicloadiciones es el hecho de que son altamente estereoespecíficas e implican adición suprafacial de ambos componentes. La configuración de los sustituyentes en el dieno y el dienófilo se retiene en el aducto:
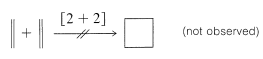
En contraste con la cicloadición [4 + 2], rara vez se observan cicloadiciones térmicas [2 + 2], y cuando se observan, no son estereoespecíficas y evidentemente son reacciones escalonadas (ver Sección 21-11):
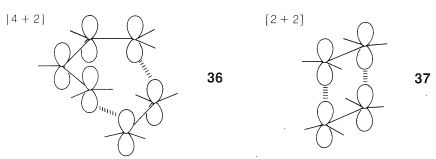
¿Por qué son diferentes las cicloadiciones [4 + 2] y [2 + 2]? La teoría orbital molecular simple proporciona una explicación elegante de esta diferencia basada en la\(4n + 2\) regla descrita en la Sección 21-9. Para entender esto, necesitamos mirar con más detalle cómo interactúan los\(p\) orbitales de los dobles enlaces en mecanismos de adición concertados por solapamiento suprafacial, como en\(36\) y\(37\):
Cómo el señor Möbius venció la\(4n + 2\) regla
Hay una forma de evitar la\(4n + 2\) regla que no es muy importante para sustancias análogas al benceno, pero es bastante importante para las reacciones de cicloadición. Veamos cómo funciona esto para un polieno conjugado cíclico.
A partir de los diagramas molecular-orbitales de las Figuras 21-5, 21-7, 21-9 y 21-14, se verá que el orbital\(\pi\) molecular de menor energía no tiene nodos (cambios de fase). Un modelo de tal orbital, que generalmente se denomina orbital de Hückel, se puede construir uniendo los extremos de una cinta o tira de\(p\) orbitales paralelos, como se representa en el lado izquierdo de la Figura 21-15. No obstante, se podría unir los orbitales haciendo un giro en la tira, lo que luego daría un orbital de menor energía con un nodo, como en el lado derecho de la Figura 21-15. Una tira con uno de esos giros se llama tira de Möbius\(^8\) y tiene la propiedad topológica de tener solo un lado.
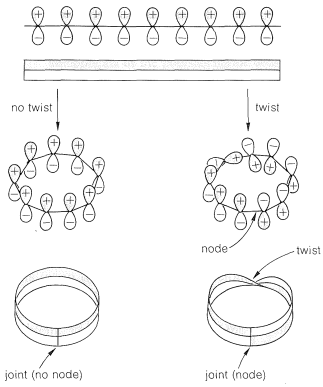
Si ahora calculamos las energías orbitales para los orbitales de Möbius, como estaba abajo para los\(\pi\) orbitales normales de Hückel en la Figura 21-13, obtenemos los resultados que se muestran en la Figura 21-16. A partir de esto, vemos que la\(4n\) situación ahora se ve favorecida y\(4n + 2\) es desfavorable. Mientras que las energías de los orbitales\(\pi\) moleculares en la disposición de Hückel pueden obtenerse inscribiendo un polígono en un círculo con una esquina hacia abajo (Sección 21-9A), en la disposición de Möbius las energías orbitales se obtienen del polígono inscrito con un lado hacia abajo .
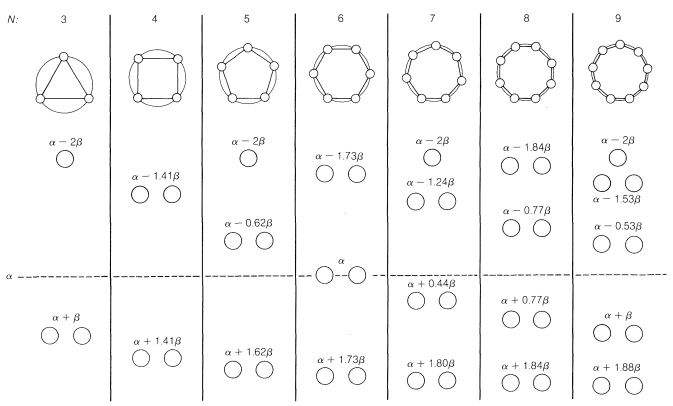
Si compara las energías orbitales de los\(\pi\) sistemas cíclicos Hückel y Möbius (Figuras 21-13 y 21-16), verá que los sistemas Hückel tienen solo un MO de menor energía, mientras que los sistemas Möbius tienen dos. Los sistemas Hückel tienen un número impar de orbitales de unión (que, cuando están llenos, acomodan 2, 6, 10, 14 o\(4n + 2\) electrones) y los sistemas Möbius tienen un número par de orbitales de unión (que, cuando están llenos, acomodan 4, 8, 12 o\(4n\) electrones). Los orbitales moleculares de Hückel tienen cero o un número par de nodos (ver, por ejemplo, los MO de benceno, Figura 21-5); los orbitales moleculares de Möbius no se muestran, pero tienen uno o un número impar de nodos.
La relevancia de todo esto puede parecer tenue, sobre todo porque no se conoce ningún ejemplo de un simple polieno cíclico con un\(\pi\) sistema Möbius. Sin embargo, el arreglo de Möbius es relevante para la cicloadición porque podemos concebir alquenos, alcadienos, etc. que se acercan entre sí para producir estados de transición de Möbius cuando los\(4n\) electrones están involucrados.
Por ejemplo, consideremos dos moléculas de eteno, las cuales demostramos anteriormente violarían la\(4n + 2\) regla al someterse a cicloadición a través de un estado de transición representado por\(37\). Existe un estado de transición alternativo\(38\), en el que los cuatro\(p\) orbitales se unen en el arreglo Möbius (con un nodo para la energía mínima).
Para lograr esta disposición las moléculas de eteno se acercan entre sí en planos aproximadamente perpendiculares de manera que los\(p\) orbitales se superponen suprafacialmente en un eteno y antarafacialmente en el otro, como se muestra en\(38\):
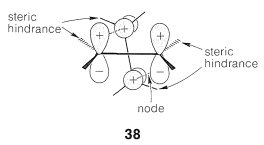
Esta vía es electrónicamente favorable, pero es probable que la interferencia estérica entre los grupos unidos al doble enlace sea severa. Tales repulsiones pueden aliviarse si no hay grupos sobresaliendo lateralmente en un extremo del doble enlace, como ocurre con el carbono central del 1,2-propadieno\(\ce{CH_2=C=CH_2}\), y la cetena,\(\ce{CH_2=C=O}\). Estas sustancias suelen sufrir [2 + 2] cicloadiciones con bastante facilidad (Sección 13-3D), y es probable que se trate de adiciones concertadas que ocurren por la ruta de Möbius.
Un estado de transición de Möbius [4 + 4] mucho menos tenso se puede formar a partir de dos moléculas s-cis de 1,3-butadieno. Cuando el 1,3-butadieno se calienta por sí mismo, se forma un pequeño porcentaje de 1,5-ciclooctadieno, pero no se sabe con certeza si el mecanismo es el que se muestra:
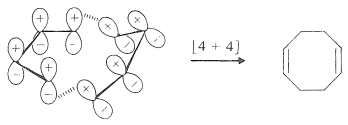
La reacción principal es una cicloadición de Diels-Alder [4 + 2], con butadieno actuando tanto como dieno como dienófilo:
Simetría Orbital. Las reglas de Woodward-Hoffmann
Mucho de lo que hemos dicho sobre los factores electrónicos que controlan si una reacción de cicloadición puede ser concertada o no originalmente fue formulado por los químicos estadounidenses R. B. Woodward y R. Hoffmann hace varios años, en términos de lo que llegó a llamarse los principios de simetría orbital, o los Woodward-Hoffmann gobierna. Los argumentos de simetría orbital son demasiado complicados para este libro y, en cambio, usaremos la regla de los\(4n + 2\) electrones para los arreglos normales de Hückel de\(\pi\) los sistemas y la regla de\(4n\) electrones para los arreglos de Möbius. Este es un enfoque particularmente sencillo entre varios disponibles para dar cuenta de los fenómenos a los que Woodward y Hoffmann llamaron especial atención y explicaron por lo que ellos llaman “conservación de la simetría orbital”.
Reordenamientos electrocíclicos y sigmatropicos
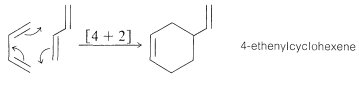
Las reacciones de cicloadición que hemos discutido hasta ahora en este capítulo ([2 + 2], [4 + 2], etc.) han implicado la formación de anillos al unir dos moléculas insaturadas. Así, la adición de [4 + 2] está representada por la reacción de Diels-Alder de eteno y 1,3-butadieno:
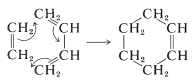
Podemos concebir ciclaciones similares que involucren solo moléculas individuales, es decir, ciclación intramolecular. Tales reacciones se llaman reordenamientos electrocíclicos. A continuación se presentan dos ejemplos para mostrar la ciclación de un dieno y un trieno:
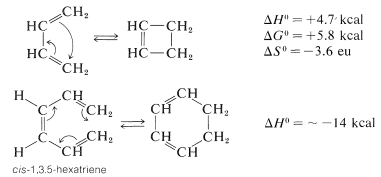
La ciclación de 1,3,5-hexatrieno ocurre solo cuando el doble enlace central tiene la configuración cis. La reacción es reversible a temperaturas elevadas debido a la ganancia de entropía en la apertura del anillo (ver Sección 4-4B). La interconversión de ciclobuteno-1,3-butadieno procede mucho menos fácilmente, incluso en la dirección termodinámicamente favorable de apertura del anillo. Sin embargo, los dienos y ciclobutenos sustituidos a menudo reaccionan más rápidamente.
Un grupo relacionado de reacciones implica desplazamientos de grupos sustituyentes de un átomo a otro; por ejemplo\(\ce{H}\), con grupos alquilo o arilo como\(\ce{R}\):
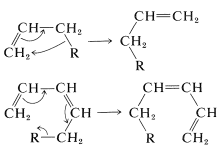
Estas reacciones se denominan reordenamientos sigmatropicos y, en general, están sujetas a la\(4n + 2\) regla y a la modificación orbital de Möbius de la misma. Los posibles reordenamientos sigmatropicos pueden reconocerse por el hecho de que el enlace sencillo al grupo migratorio\(\left( \ce{R} \right)\) está “conjugado” con los\(\pi\) enlaces, y el grupo pasa de un\(sp^2\) carbono saturado\(sp^3\) a uno en una parte diferente del\(\pi\) sistema.
La estereoquímica de los reordenamientos electrocíclicos
Una característica llamativa de las reacciones electrocíclicas térmicas que proceden por mecanismos concertados es su alto grado de estereoespecialidad. Así, cuando se calienta cis-3,4-dimetilciclobuteno, proporciona solo uno de los tres posibles isómeros cis-trans de 2,4-hexadieno, a saber, cis, trans-2,4-hexadieno:
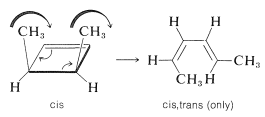
Podemos ver cómo esto puede ocurrir si, a medida que se abre el anillo, los extremos del dieno se tuercen en la misma dirección (\(\curvearrowright \curvearrowright\)o\(\curvearrowleft \curvearrowleft\), conrotatoria) como se indica en la ecuación. Notarás que con este caso particular, si se produce la conrotación hacia la izquierda, en lugar de hacia la derecha, el mismo producto final resulta:
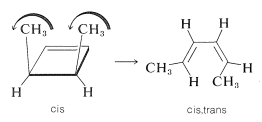
El movimiento conrotatorio de grupos es típico de las aberturas térmicas de anillos de ciclobutenos y otros anillos que involucran\(4n\) electrones.
Cuando un ciclobuteno está constituido de tal manera que la conrotación no puede ocurrir por razones estéricas, entonces la reacción concertada no puede ocurrir fácilmente. Las sustancias que de otro modo podrían predecirse que serían altamente inestables a menudo resultan ser relativamente estables. Un ejemplo es el biciclo [2.1.0] -2-penteno, que a primera vista podría parecer incapaz de aislamiento debido a la posibilidad de disposición inmediata al 1,3-ciclopentadieno. Este reordenamiento ocurre, pero no tan rápido como para excluir el aislamiento de la sustancia:

¿Cómo podemos explicar el hecho de que esta sustancia pueda aislarse? La explicación es que, si la reacción tiene que ser conrotatoria, entonces el producto no será 1,3-ciclopentadieno ordinario, sino cis, trans -1,3-ciclopentadieno -seguramente una sustancia muy colada. (¡Intenta hacer un modelo de bola y palo!) Esto significa que el mecanismo concertado no es favorable:
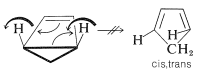
Es de gran interés e importancia que, con sistemas de\(4n + 2\) electrones, los grupos se muevan en direcciones opuestas (\(\curvearrowleft \curvearrowright\)o\(\curvearrowright \curvearrowleft\), disrotatorias). Por ejemplo,
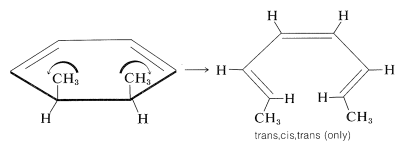
En este caso, la disrotación de los grupos uno hacia el otro conduciría al producto cis, cis, cis. Debido a que este producto no se forma, parece probable que la rotación de los grupos metilo entre sí debe ser estéricamente desfavorable:

¿Cómo podemos dar cuenta de la estereoselectividad de las reacciones electrocíclicas térmicas? Nuestro problema es entender por qué es que los reordenamientos\(4n\) electrocíclicos concertados son conrotatorios, mientras que los\(4n + 2\) procesos correspondientes son disrotatorios. De lo que se ha dicho anteriormente, podemos esperar que los procesos conrotatorios estén relacionados con los orbitales moleculares de Möbius y los procesos disrotatorios estén relacionados con los orbitales moleculares de Hückel. Veamos por qué esto es así. Considere la interconversión electrocíclica de un 1,3-dieno y un ciclobuteno. En este caso, el estado de transición de Hückel (uno que tiene un número par de nodos) se forma por desrotación, pero es desfavorable con cuatro (es decir,\(4n\)) electrones:
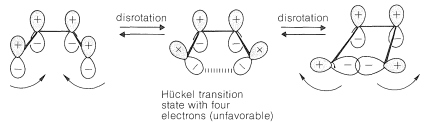
Por el contrario, el estado de transición de Möbius (uno que tiene un número impar de nodos) se forma por conrotación y es favorable con cuatro\(\left( 4n \right)\) electrones:
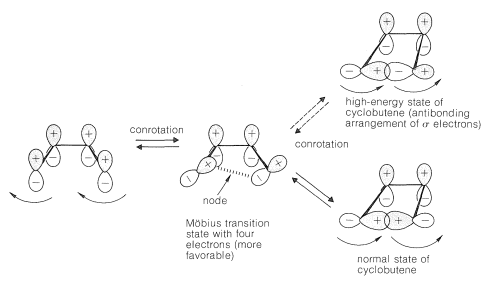
Notarás que el cierre de anillo de un 1,3-dieno a través del favorable estado de transición de Möbius puede parecer capaz de formar solo una disposición antiadhesión de los\(\sigma\) orbitales superpuestos, lo que correspondería a un ciclobuteno de alta energía. De hecho, se formaría el ciclobuteno normal, porque en el camino hacia abajo del estado de transición, las fases de los orbitales que se convertirán en el\(\sigma\) enlace cambian para dar la disposición de unión de los\(\sigma\) orbitales que se espera para el estado fundamental. Lo contrario ocurre en la apertura del anillo de manera que esta reacción también puede pasar por el favorable estado de transición de Möbius.
El mismo razonamiento puede extenderse a reacciones electrocíclicas de 1,3,5-trienos y 1,3-ciclohexadienos, que involucran\(4n + 2\) electrones y consecuentemente favorecen los estados de transición de Hückel alcanzados por la desrotación.
Resumen de Reglas para Predecir Reacciones Pericíclicas Térmicamente Favorables
Los tres tipos principales de reacciones pericíclicas son la cicloadición, el reordenamiento electrocíclico y el reordenamiento sigmatropico:
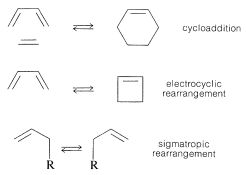
Los factores que controlan si y cómo ocurren estas reacciones de ciclación y reordenamiento de manera concertada se pueden entender a partir de la aromaticidad o falta de aromaticidad lograda en sus estados de transición cíclicos. Para que una reacción pericíclica concertada sea térmicamente favorable, el estado de transición debe involucrar electrones\(4n + 2\) participantes si se trata de un sistema orbital de Hückel, o\(4n\) electrones si es un sistema orbital de Möbius. Un estado de transición de Hückel es aquel en el que la matriz cíclica de orbitales participantes no tiene nodos (o un número par) y un estado de transición de Möbius tiene un número impar de nodos.
Resumimos aquí un procedimiento para predecir la factibilidad y la estereoquímica de reacciones térmicamente concertadas que involucran estados de transición cíclicos. Se utilizará el reordenamiento 1,2 de carbocationes para ilustrar el enfoque. Esta es una reacción muy importante de carbocationes que hemos discutido en otros capítulos. Lo usamos aquí como ejemplo para ilustrar cómo la teoría cualitativa de MO puede dar una idea de cómo y por qué ocurren las reacciones:
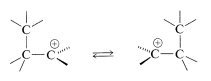
El primer paso del procedimiento es dibujar los orbitales ya que se espera que estén involucrados en el estado de transición. Puede haber varios arreglos posibles. Hay dos arreglos de este tipo,\(41\) y\(42\), para el reordenamiento de carbocationes; las líneas punteadas muestran las regiones de formación de enlaces y ruptura de enlaces (es decir, superposición orbital):
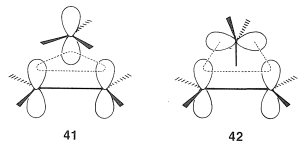
El segundo paso es determinar si los estados de transición son Hückel o Möbius a partir del número de nodos. Esto se hace fácilmente asignando señales a los lóbulos de los orbitales correspondientes a sus fases y contando el número de nodos que se desarrollan en el círculo de orbitales superpuestos. Un número impar denota un estado de transición de Möbius, mientras que un número par, incluyendo cero, denota un estado de transición de Hückel.
Existen formas alternativas de conteo de nodos para estados de transición\(41\) y\(42\). Diagramas\(43abc\) y\(44abc\) representan orbitales moleculares de diferentes energías - aquellas con más nodos que tienen las energías superiores (ver Sección 21-3C). \(^9\)Mostramos estos diagramas con más de un nodo en aras de la integridad. No es necesario dibujar más de uno de esos diagramas para determinar si el estado de transición es Möbius o Hückel.
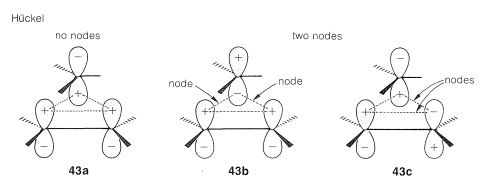
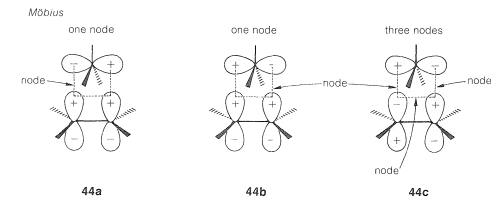
Finalmente, evaluamos los estados de transición de acuerdo con la\(4n + 2\) regla\(4n\) o. En el ejemplo aquí, debido a que sólo dos electrones ocupan los orbitales moleculares, el estado de transición de Hückel (\(43a\)) es el favorable.
Una ventaja proveniente de estas formulaciones es que la estereoquímica de la reacción se puede predecir cuando hemos predicho qué estado de transición es el favorecido. Así, el grupo migratorio en reordenamientos de 1,2-carbocationes debe moverse con retención de configuración por un estado de transición de Hückel, y esto se ha verificado experimentalmente. El estado de transición alternativo de Möbius predice la inversión de la configuración del grupo migratorio:
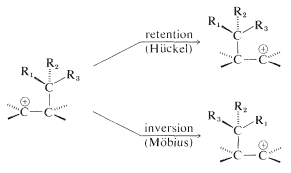
Puede utilizar los procedimientos que se acaban de describir para determinar si es probable que alguna reacción térmica con un estado de transición cíclica sea favorable. Un buen lugar para comenzar es la cicloadición Diels-Alder [4 + 2], que procede térmicamente por un estado de transición suprafacial (Hückel). Sugerimos que aplique el procedimiento a la reacción de Diels-Alder de 1,3-butadieno y eteno, y después de eso, mostrar que la apertura del anillo electrocíclico de un anillo de ciclobuteno es térmicamente favorable solo por una apertura conrotatoria del\(\ce{C-C}\) enlace.
Reacciones Pericíclicas Fotoquímicas
Muchas reacciones pericíclicas tienen lugar fotoquímicamente, es decir, por irradiación con luz ultravioleta. Un ejemplo es la conversión de norbornadieno a cuadricicleno, descrita en la Sección 13-3D. Esta reacción tendría un mecanismo desfavorable [2 + 2] si se intentara por simple calentamiento. Además, la termodinámica favorece la apertura del anillo en lugar del cierre del anillo. Sin embargo, el cuadricicleno puede aislarse, aunque sea muy tenso, ya que para reabrir el anillo térmicamente implica el reverso de algún mecanismo desfavorable de cicloadición [2 + 2].
La activación fotoquímica puede ser utilizada para lograr cicloadiciones directas o inversas y reacciones electrocíclicas que son termodinámicamente desfavorables o tienen mecanismos térmicos concertados desfavorables. Así, el producto disrotatorio termodinámicamente inestable [2 + 2] se puede obtener a partir de 1,3-ciclopentadieno por irradiación con luz ultravioleta:

Los resultados estereoquímicos de las reacciones electrocíclicas y de cicloadición llevadas a cabo fotoquímicamente a menudo son opuestos a lo que se observa para las reacciones térmicas correspondientes. Sin embargo, se conocen excepciones y el grado de estereoespecificidad no siempre es tan alto como en las reacciones térmicas. Otros ejemplos de reacciones pericíclicas fotoquímicas se dan en la Sección 28-2D.
\(^8\)El nombre del matemático A. F. Möbius.
\(^9\)La asignación de fases orbitales debe tener debidamente en cuenta la simetría molecular, y aunque esto es fácil para los sistemas de cadena abierta, es mucho menos sencillo para los cíclicos. Por lo general, podrás evitar este problema tratando siempre de configurar los orbitales para que el estado de transición no tenga nodos, o solo un nodo en un punto donde se esté haciendo o rompiendo un vínculo.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


