21.12: Evidencia que incide en el mecanismo de [2 + 2] Cicloadiciones
- Page ID
- 72872
No le hemos dado mucha evidencia para decidir por qué es que ocurren algunas cicloadiciones térmicas [2 + 2] pero no otras. ¿Qué tienen de especial los fluoroalquenos, alenos y cetenos en estas reacciones? Una posibilidad es que Mobius en lugar de los estados de transición Huckel estén involucrados, pero se espera que los estados de transición de Mobius sufran obstáculos estéricos (Sección 21-10B). También es posible que las cicloadiciones [2 + 2], a diferencia de las adiciones de Diels-Alder, procedan por mecanismos escalonados. Esta posibilidad está fuertemente respaldada por el hecho de que estas reacciones generalmente no son estereoespecíficas. Así, con tetrafluoroeteno y trans, trans-2,5-hexadieno se forman dos productos, los cuales difieren en que el grupo 1-propenilo es trans al grupo metilo en un aducto\(45\), y cis en el otro,\(46\):
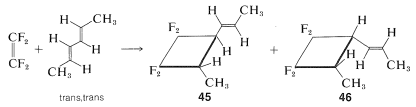
Una reacción paso a paso que involucra un intermedio birradical explica la formación de ambos\(45\) y\(46\). En el mecanismo birradical el primer paso es la formación de un solo\(\ce{C-C}\) enlace entre los reactivos, y esto podría ocurrir de dos maneras diferentes para dar\(47\) o\(48ab\):
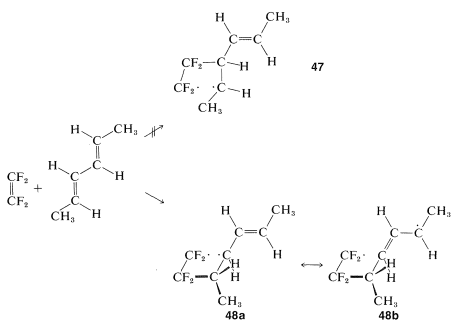
De estos,\(48ab\) se prevé que tenga una deslocalización sustancial de electrones debido a las estructuras VB casi equivalentes\(48a\) y\(48b\). Por la simple teoría MO\(48ab\) debe tener una energía de deslocalización de\(16 \: \text{kcal mol}^{-1}\) (Sección 21-5B). El birradical no\(47\) tiene deslocalización electrónica comparable y se esperaría que se formara mucho menos fácilmente.
El colapso de la formación\(48\) a través del segundo\(\ce{C-C}\) enlace daría\(45\) una adición estereoespecífica global. Sin embargo, la rotación alrededor del enlace\(\ce{C-C}\) sencillo de\(48\) forma una conformación radical diferente\(49\), que colapsaría al otro estereoisómero,\(46\):
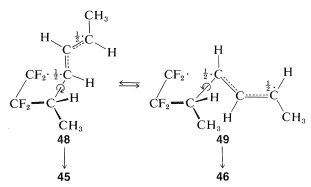
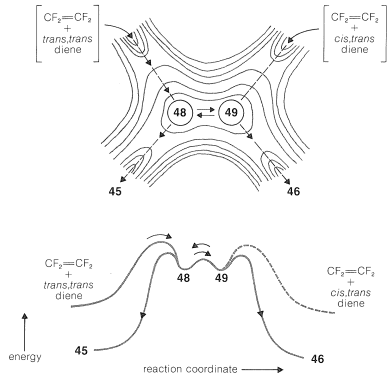
Si la reacción es paso a paso, ¿por qué es paso a paso? En primer lugar, como hemos visto (Sección 21-10A), existen razones teóricas por las cuales [2 + 2] las cicloadiciones pueden no ocurrir de manera concertada. En segundo lugar, hay razones termodinámicas por las que algunos alquenos se someten a adiciones paso a paso [2 + 2] y otros no. Respecto al segundo punto, podemos estimar que\(2 \ce{CH_2=CH_2} \rightarrow \cdot \ce{CH_2-CH_2-CH_2-CH_2} \cdot\) tiene\(\Delta H^0 \sim 37 \: \text{kcal}\), que es demasiado alto para lograr a una tasa útil a aquellas temperaturas donde la constante de equilibrio es favorable para la formación de ciclobutano. Es decir, cuando\(K_\text{eq}\) es favorable, la tasa es demasiado lenta, y cuando la tasa es lo suficientemente rápida,\(K_\text{eq}\) es desfavorable. En contraste,\(2 \ce{CF_2=CF_2} \rightarrow \cdot \ce{CF_2-CF_2-CF_2-CF_2} \cdot\) se estima tener\(\Delta H^0 = -7 \: \text{kcal}\)! Esto nos dice que\(\ce{CF_2=CF_2}\) tiene una energía de\(\ce{C=C}\)\(\pi\) enlace anormalmente baja y, de hecho,\(\Delta H^0\) para la adición de hidrógeno a un mol de tetrafluoroeteno\(\left( -55 \: \text{kcal} \right)\) es\(22 \: \text{kcal}\) más negativa que\(\Delta H^0\) para el eteno\(\left( -33 \: \text{kcal} \right)\). Si la formación de\(\cdot \ce{CF_2-CF_2-CF_2-CF_2} \cdot\) from\(2 \ce{CF_2=CF_2}\) en realidad es exotérmica, entonces puede parecer sorprendente que se\(\ce{CF_2=CF_2}\) pueda guardar en un recipiente sin reaccionar inmediatamente consigo mismo. Eso puede es porque se requieren colisiones de bastante alta energía para superar las repulsiones no unidas que resisten acercar los carbonos lo suficiente como para permitir la formación del birradical. Sin embargo,\(\ce{CF_2=CF_2}\) generalmente es considerado como un químico peligroso e impredecible en virtud de su inusualmente baja fuerza\(\ce{C=C}\)\(\pi\) de unión.
El 1,2-propadieno también parece tener el potencial para la formación de un birradical mucho más fácil que el eteno. No todas las [2 + 2] cicloadiciones proceden por mecanismos biradicales, algunas ocurren claramente por reacciones escalonadas que involucran intermedios iónicos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


