22.5: Efecto de los Sustituyentes sobre la Reactividad y Orientación en Sustitución Aromática Electrofílica
- Page ID
- 73619
En la planificación de síntesis basadas en reacciones de sustitución de bencenos sustituidos, es imperativo poder predecir de antemano cuáles de las posiciones disponibles del anillo son probablemente más reactivas. Esto ahora es posible con un grado bastante alto de certeza, gracias al trabajo de muchos químicos durante los últimos 100 años. Pocos, si los hay, otros problemas en la química orgánica han recibido tanta atención a lo largo de tantos años, y ahora hay suficientes datos sobre los efectos de orientación y reactividad de los sustituyentes del anillo en la sustitución electrófila para permitir la formación de algunas generalizaciones muy valiosas.
Básicamente, tres problemas experimentales están involucrados en las reacciones de sustitución de compuestos aromáticos: (1) prueba de estructura de los isómeros que se forman; (2) determinación del porcentaje de cada isómero formado, si el producto es una mezcla; y (3) medición de la reactividad del compuesto siendo sustituido en relación con alguna sustancia estándar, generalmente benceno.
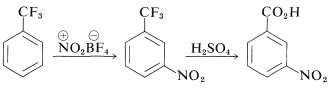
Para los compuestos benzenoides, las estructuras pueden establecerse mediante el método de sustitución históricamente importante (Sección 1-1F) o con la ayuda de correlaciones entre las propiedades espectroscópicas y las posiciones de sustitución, como indicamos en la Sección 22-3. Además, a menudo es posible identificar los isómeros convirtiéndolos en compuestos de estructura conocida. Por ejemplo, trifluorometilbenceno en la nitración da solo un producto, que se ha demostrado que es el derivado 3-nitro por conversión al ácido 3-nitrobenzoico conocido por ácido sulfúrico concentrado:
Las proporciones de isómeros formados en las reacciones de sustitución se pueden determinar por medios espectroscópicos o por los métodos analíticos de separación discutidos en la Sección 9-2. Nos preocupa principalmente en este capítulo la reactividad y orientación observada en la sustitución aromática.
El patrón de orientación en la sustitución aromática
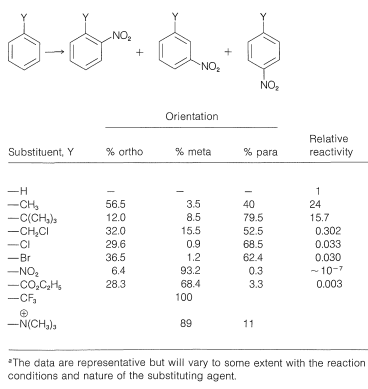
La reacción más estudiada en relación con el problema de orientación es la nitración, pero los principios establecidos también se aplican en su mayor parte a las reacciones relacionadas de halogenación, sulfonación, alquilación y acilación. Algunos datos ilustrativos para la nitración de una serie de derivados de benceno monosustituidos se dan en la Tabla 22-5. La tabla incluye el porcentaje de isómeros orto, meta y para formados, junto con sus reactividades relativas al benceno. Vemos que existe un amplio rango de reactividad según la naturaleza del sustituyente, y que las posiciones orto, meta y para no son igualmente reactivas. Si bien estos efectos sustituyentes pueden parecer complejos, están estrechamente relacionados con los alquenos sustituidos (Sección 10-4), como se explicará en el siguiente apartado.
Cuadro 22-5: Datos de orientación y velocidad para la nitración de algunos derivados de benceno monosustituidos\(^a\)
Efectos Electrónicos
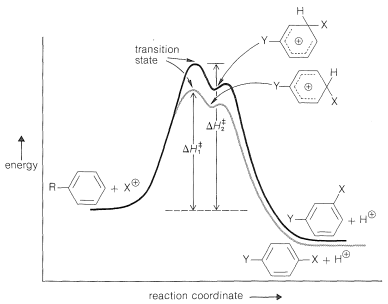
Es útil construir un diagrama de energía para la sustitución por un electrófilo\(\ce{X}^\oplus\) de un derivado de benceno\(\ce{C_6H_5Y}\), en el que\(\ce{Y}\) se encuentra un grupo sustituyente (Figura 22-8). La tasa de sustitución en cualquier posición (hemos elegido arbitrariamente en la Figura 22-8 para comparar las posiciones 3 y 4) dependerá de la altura de la barrera energética entre los reactivos y el estado de transición. Los efectos que actúan para bajar las alturas de las barreras aumentan las tasas de sustitución. Debido a que el estado de transición y el intermedio cargado positivamente para la sustitución aromática tienen mucha la misma energía, es probable que cualquier efecto que estabilice este intermedio disminuya la energía del estado de transición y aumente la tasa de sustitución. Así, bajo condiciones de control cinético el producto preferido de sustitución de areno, como en la adición de alquenos, será el derivado de los intermedios más estables posibles. Por lo tanto, el problema de predecir tasas relativas y orientación en la sustitución aromática se convierte en uno de decidir qué factores son susceptibles de estabilizar o desestabilizar los diversos intermedios posibles entre sí y con respecto al estado fundamental.
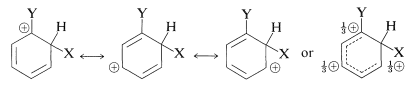
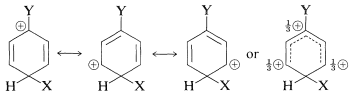
Ahora podemos examinar las estructuras de los tres intermedios de sustitución con el fin de decidir cómo el sustituyente podría afectar su estabilidad. De acuerdo con el método de enlace de valencia, la carga positiva en el anillo se dispersa principalmente en carbonos alternos, como se muestra a continuación.
sustitución orto
para sustitución
meta-sustitución
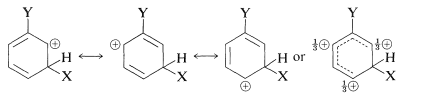
El sustituyente\(\ce{Y}\) debe (y lo hace) ejercer su influencia electrónica más fuertemente desde las posiciones orto y para que desde la posición meta porque\(\ce{Y}\) en las posiciones orto y para está cerca de un carbono del anillo cargado positivamente. Esta influencia electrónica será estabilizante si\(\ce{Y}\) tiene un efecto donador de electrones neto, y desestabilizante si\(\ce{Y}\) es retirada de electrones. Un grupo puede retirar electrones con relación al hidrógeno si es más electronegativo que el hidrógeno y esto se denomina efecto inductivo aceptor de electrones (ver también la Sección 18-2B). Un grupo también puede retirar electrones por el efecto de resonancia:
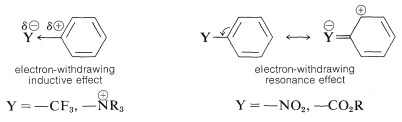
En consecuencia, los sustituyentes entran en una de las siguientes categorías.
Sustituyentes meta-direccionales
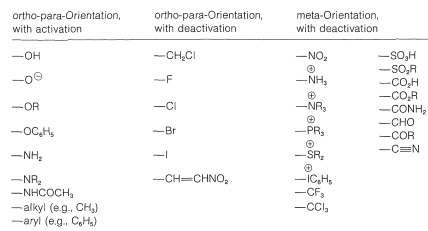
Un sustituyente de anillo\(\ce{Y}\) que es atrayente electrones con relación al hidrógeno y no tiene capacidad para donar electrones por un efecto de resonancia disminuirá la reactividad de\(\ce{C_6H_5Y}\), especialmente en las posiciones orto y para. El resultado es una reacción lenta (desactivación) con sustitución que ocurre preferentemente en la posición meta. Los sustituyentes en esta categoría son\(\ce{-NO_2}\)\(\ce{-CF_3}\),\(\ce{-CO_2R}\),\(\ce{-} \overset{\oplus}{\ce{N}} \ce{R_3}\), y así sucesivamente (ver también las Tablas 22-5 y 22-6). No se conocen grupos que dirijan el electrófilo a la posición meta y, al mismo tiempo, hagan que el derivado fenílico sea más reactivo en relación con el benceno.
Tabla 22-6: Efectos de orientación y reactividad de sustituyentes en el anillo
Sustituyentes orto-para
1. Un sustituyente del anillo\(\ce{-Y}\),, que tiene un par de electrones en el átomo adyacente al anillo da sustitución orto-para en preferencia a la sustitución meta. La razón es que el intermedio puede ser estabilizado por un efecto de resonancia donadora de electrones a partir de\(\ce{Y}\) que es efectivo solo desde las posiciones orto y para:
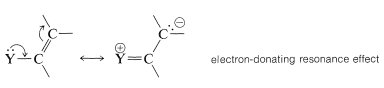
Este efecto queda claro en las estructuras de enlace de valencia para los intermedios de sustitución orto-para a partir del bencenol (fenol):
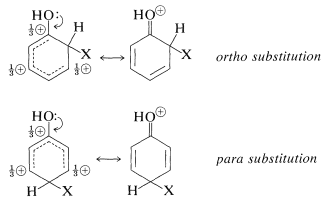
Los sustituyentes del tipo\(\ce{-Y}\) incluyen\(\ce{-OH}\)\(\ce{-OR}\),\(\ce{-SR}\),\(\ce{-NH_2}\), y halógenos. La mayoría de estos grupos también son extractores de electrones por un efecto inductivo que se opone a su efecto de resonancia. Sin embargo, como vimos en el caso de las adiciones de alquenos (Sección 10-4C), incluso cuando\(\ce{-Y}\) es un grupo electronegativo, la estabilización del catión intermedio por donación de\(\ce{Y}\) electriones no compartidos del carbono positivo adyacente compensa más que la absorción de electrones polares propiedades de\(\ce{Y}\). La donación de electrones controla así la orientación. Sin embargo, si el grupo es fuertemente atrayente de electrones (por ejemplo\(\ce{-Y} = \ce{-F}\)\(\ce{-Cl}\),\(\ce{-Br}\),,,\(\ce{-I}\)), la reactividad del compuesto\(\ce{C_6H_5Y}\) puede reducirse. Grupos de este tipo son orto-para dirigiendo con desactivación.
Pero si el efecto polar no es pronunciado, entonces la sustitución puede ser poderosamente asistida por el sustituyente. Esta es la dirección orto-para con activación y es proporcionada por grupos como\(\ce{-OH}\),\(\ce{-OR}\),\(\ce{-SR}\), y\(\ce{-NH_2}\). Una lista más completa de sustituyentes y sus efectos de orientación se proporciona en la Tabla 22-6.
2. Cuando no es posible un efecto importante de\(\pi\) electrones, como ocurre con los grupos alquilo, el efecto de orientación de un sustituyente se controla por su efecto polar y el grado en que polariza los electrones de unión del anillo. Los grupos alquilo en realidad son donantes de electrones y por lo tanto son orto-para dirigiendo con activación.

Efectos Estéricos
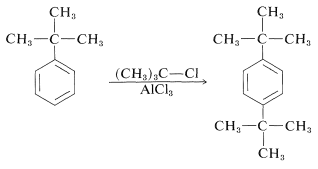
Hasta el momento no hemos hecho distinción alguna entre las reactividades de las posiciones orto y para, sin embargo, claramente no son iguales. Si fueran iguales, la relación orto:para sería 2:1, reflejando así el hecho de que hay dos posiciones orto pero sólo una posición para en los bencenos monosustituidos. La mayoría de las reacciones de sustitución favorecen el producto para, a veces en una cantidad considerable (ver Cuadro 22-5). Una explicación razonable es que la sustitución orto está sujeta a impedimento estérico entre el sustituyente y el grupo entrante. terc- butilbenceno, por ejemplo, da mucha menos orto-nitración que el metilbenceno (Cuadro 22-5), sugiriendo así que el tamaño del sustituyente es importante. Además, el terc- butilbenceno no da orto alquilación con cloruro de terc- butilo, lo que sugiere que el tamaño del grupo entrante también es importante:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


