22.7: Sustitución IPSO
- Page ID
- 73585
Para todos los fines prácticos, la sustitución aromática electrófila se limita a la sustitución de un hidrógeno del anillo. ¿Significa esto que un electrófilo como\(\ce{NO_2^+}\) solo ataca los carbonos que contienen hidrógeno? ¿Qué pasa con los carbonos de anillo sustituidos?
El ataque electrofílico a los carbonos que llevan metilo, particularmente en orto - y para - dimetilbencenos, parecería bastante razonable porque el carácter donador de electrones del otro grupo metilo debería activar el anillo estabilizando el ion intermedio:
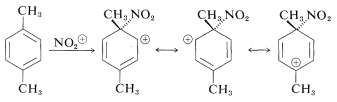
El ataque al carbono sustituido (ipso) evidentemente ocurre, pero no conduce directamente a productos de sustitución porque la desmetilación, a diferencia de la desprotonación, no ocurre:
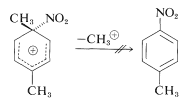
En su lugar, el grupo nitro cambia de posición al carbono del anillo vecino, que luego puede eliminar un protón para formar un producto de sustitución:
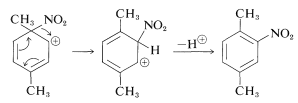
Debido a que el producto obtenido indirectamente (por sustitución ipso) es indistinguible del esperado por ataque electrofílico directo a\(\ce{C_2}\), no es posible decir cuánto, si lo hay, producto se forma por la ruta ipso en esta reacción.
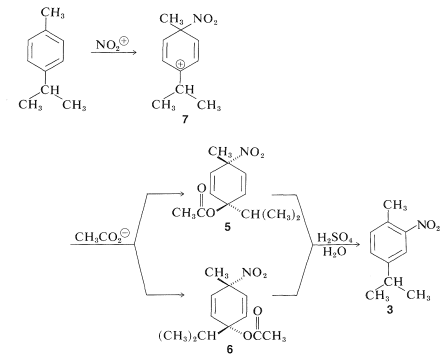
En general, los efectos de orientación en la sustitución de alquilbencenos se complican por el ataque ipso. Por ejemplo, en la nitración de 4-metilisopropilbenceno (para -cimeno) aproximadamente\(10\%\) del producto de nitración es 4-nitrobetilbenceno:
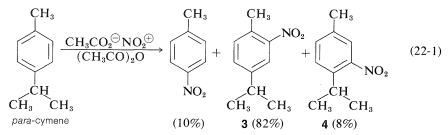
El 4-nitrobetilbenceno surge del ataque ipso del\(\ce{NO_2^+}\) carbono del anillo isopropil-sustituido. A diferencia del metilo, el grupo isopropilo se elimina rápidamente como propeno. ¿Podemos decir que los demás productos,\(3\) y\(4\), surgen por sustitución directa? Evidentemente no, porque la nitración\(0^\text{o}\) da otros dos productos,\(5\) y\(6\), que deben estar formados por ataque ipso en el carbono portador de metilo. A bajas temperaturas, el ion intermedio\(7\) es atacado por el ion etanoato débilmente nucleofílico para dar\(5\) y\(6\). Ambos aductos se solvolizan rápidamente en ácido\(78\%\) sulfúrico para dar\(3\) solo:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


