22.9: Reacciones de adición de Arenes
- Page ID
- 73610
Hidrogenación catalítica
Los compuestos bencenoides no se convierten fácilmente en derivados de ciclohexano. Sin embargo, se llevan a cabo varias reacciones de adición a escala industrial. Anteriormente se mencionó la hidrogenación de benceno a ciclohexano en presencia de un catalizador de níquel:
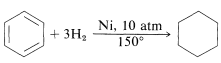
La reacción es muy importante porque el ciclohexano es ampliamente utilizado como disolvente y además se oxida a ciclohexanona, e importante intermedio en la síntesis de ácido hexanodioico (adípico) y azacicloheptan-2-ona (caprolactama), los cuales se utilizan en la preparación de nylon (Sección 24-3C).
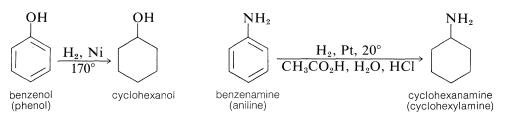
Otros compuestos de ciclohexilo se obtienen por hidrogenación catalítica de los derivados de benceno correspondientes. Así, el ciclohexanol se obtiene a partir del bencenol, y la ciclohexanamina se obtiene a partir de la bencenamina (anilina):
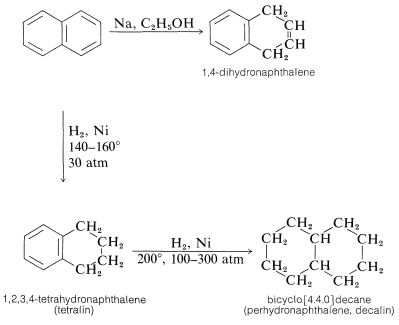
La naftalina se puede reducir más fácilmente que el benceno. Con sodio en alcohol, se forma 1,4-dihidronaftaleno. La hidrogenación catalítica da tetralina (1,2,3,4-tetrahidronaftaleno). Se puede lograr una reducción adicional para dar perhidronaftaleno (decalina) en hidrogenación catalítica prolongada a temperaturas y presiones relativamente altas:
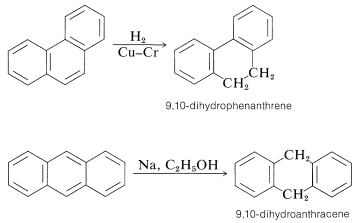
El fenantreno y el antraceno se reducen fácilmente al nivel dihidro mediante la adición a las 9,10 posiciones. La reducción adicional de los anillos terminales de benceno es relativamente difícil:
Reducción de Arenos con Metales
La hidrogenación catalítica del benceno no se puede detener en ciclohexano o ciclohexadieno; procede a ciclohexano. Esto se debe a que la velocidad del primer paso de adición es mucho más lenta que la de los pasos siguientes:
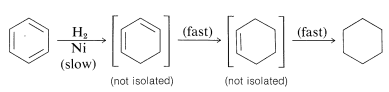
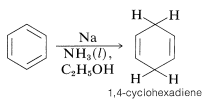
Sin embargo, el benceno y sus derivados pueden reducirse a ciclohexadienos mediante soluciones de metales como\(\ce{Li}\),\(\ce{Na}\),\(\ce{K}\)\(\ce{Zn}\), y\(\ce{Hg}\) en un disolvente débilmente ácido, como amoníaco líquido, aminas o mezclas de éter-alcohol. Este tipo general de reacción se conoce como la reducción de abedul después de que el químico australiano, A. J. Birch. Con benceno, la reducción con metales conduce a 1,4-ciclohexadieno:
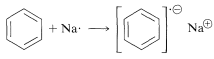
Las etapas posteriores incluyen una secuencia de etapas de transferencia de protones y electrones como sigue:
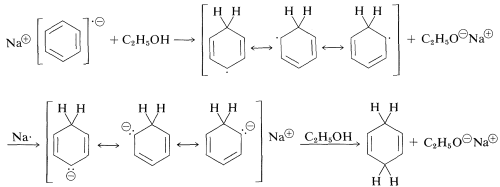
Los efectos de los sustituyentes observados para esta reacción son totalmente consientes con los descritos para la sustitución y adición electrófila, solo invertidos. Es decir, la reactividad de un areno en las reducciones de metales es incrementada por grupos aceptores de electrones y disminuida por grupos donadores de electrones. Los sustituyentes que pueden estabilizar el intermedio anión-radical facilitan la reducción.
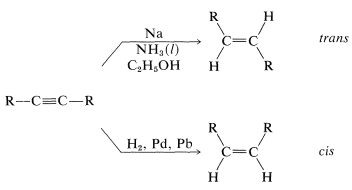
La reducción con metales en disolventes débilmente ácidos no se limita a los arenos. Una reacción relacionada útil reduce alquinos a trans-alquenos, y proporciona una alternativa útil a la hidrogenación catalítica, lo que favorece la formación de cis-alquenos (Sección 11-2A):
Adición de halógenos
El benceno añadirá cloro en la irradiación con luz para dar el hexaclorociclohexano completamente saturado como una mezcla de estereoisómeros:
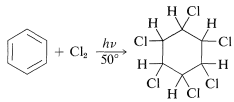
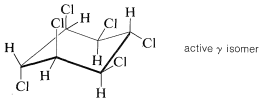
La reacción es comercialmente importante porque uno de los isómeros es un potente insecticida. El producto se comercializa como una mezcla de isómeros en la que el isómero activo\(\left( \gamma \right)\) es óptimamente aproximadamente en\(40\%\) peso. Tiene una variedad de nombres comerciales: Fortificado, BHC, Lindano, Gammexano, Hexaclor.
Cicloadición
En el Capítulo 13 encontramos la reacción de Diels-Aler, la cual implica la adición de un alqueno reactivo (dienófilo) a las posiciones 1,4 de un dieno conjugado. Ni el benceno ni el naftaleno reaccionan significativamente con los dienófilos en un simple calentamiento, pero el antraceno reacciona. La cicloadición ocurre entre las 9,10 posiciones:
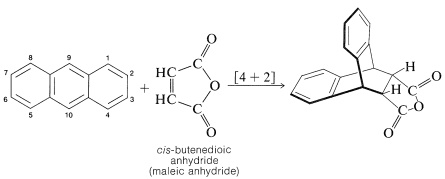
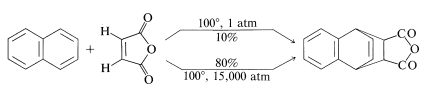
Las reacciones en las que el estado de transición tiene un volumen menor que los reactivos se aceleran por un aumento en la presión. Este es el caso de naftaleno y anhídrido cis-butenodioico. Se obtiene un\(80\%\) rendimiento de aducto\(100^\text{o}\) a 15,000 atmósferas de presión, mientras que a una atmósfera y\(100^\text{o}\), el rendimiento es solo\(10\%\).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


