22.12: Algunos polienos cíclicos conjugados
- Page ID
- 73584
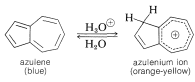
Azulene
Existen varios compuestos que poseen alguna medida de carácter aromático típico del benceno, pero no poseen un anillo bencenoide. Adecuadamente, tienen\(\left( 4n + 2 \right)\)\(\pi\) electrones y se clasifican como compuestos aromáticos no benzenoides (Sección 21-9). Un ejemplo es el azuleno, que es isomérico con naftaleno y tiene un anillo de cinco y siete miembros fusionado a través de carbonos adyacentes:
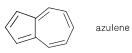
Como su nombre lo indica, es de color azul profundo. Es menos estable que el naftaleno, al que isomeriza cuantitativamente al calentar arriba\(350^\text{o}\) en ausencia de aire:
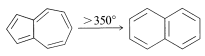
El azuleno tiene una polaridad significativa, con el anillo de cinco miembros negativo y el anillo de siete miembros positivo. La estructura se puede representar como un híbrido de estructuras neutras e iónicas:
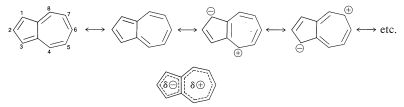
La polarización que tiene el anillo de cinco elementos negativo y el anillo de siete eslabones positivo corresponde a estructuras iónicas que tienen seis (es decir,\(4n + 2\)) electrones en los anillos de cinco y siete eslabones (Sección 21-9B).
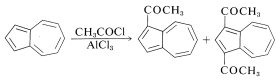
De acuerdo con su carácter aromático y distribución asimétrica de carga, el azuleno experimenta ciertas reacciones de sustitución electrofílica típicas en las posiciones 1 y 3. Así, la acilación de Friedel-Crafts conduce a una mezcla de 1-etanoilazuleno y 1,3-dietanoilazuleno:
Además, en presencia de ácidos fuertes la posición 1 se protonó para dar un derivado del ion cicloheptatrienilo (tropilio) relativamente estable (Sección 21-9B):
Ciclooctatetraeno
El 1,3,5,7-ciclooctatetraeno (o simplemente ciclooctatetraeno) es un compuesto no aromático, no plano, de color amarillo brillante (Sección 21-9A). Aparentemente la energía de resonancia de una estructura plana es insuficiente para superar la deformación angular desfavorable que tendría una estructura plana con sus ángulos de\(\ce{C-C-C}\) unión de\(135^\text{o}\). El ciclooctatetraeno normalmente asume una estructura de “cuba” con enlaces simples y dobles alternantes:
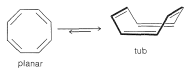
Sin embargo, hay evidencia de RMN que indica que la forma de cuba está en rápido equilibrio con una cantidad muy pequeña de la forma plana a temperatura ambiente. Hay alrededor de una\(15\) - diferencia de\(\text{kcal mol}^{-1}\) energía entre las dos formas. La dicación\(\ce{C_8H_8^{2+}}\),, y el dianión del ciclooctatetraeno\(\ce{C_8H_8^{2-}}\), que tienen\(\left( 4n + 2 \right)\)\(\pi\) electrones, parecen existir en conformación plana.
El ciclooctatetraeno se puede preparar fácilmente por polimerización de etino en presencia de cianuro de níquel:
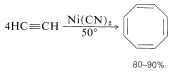
Podría fabricarse a gran escala, pero aún no se han desarrollado usos comerciales a gran escala de la sustancia.
La química del ciclooctatetraeno es interesante e inusual. Particularmente destacable es la forma en que experimenta reacciones de adición para formar productos que parecen derivarse del isómero bicíclico, biciclo [4.2.0] 2,4,7-octatrieno,\(8\). De hecho, existe un equilibrio electrocíclico entre ciclooctatetraeno y\(8\) (Sección 21-10D) y, aunque la posición de equilibrio se encuentra lejos del lado del ciclooctatetraeno,\(8\) es más reactiva y conduce a los productos de adición observados:
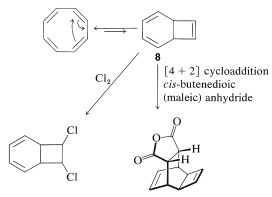
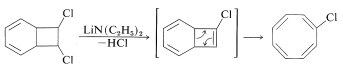
El tratamiento del dicloruro puenteado con bases fuertes provoca la eliminación del cloruro de hidrógeno y la formación de clorociclooctatetraeno:
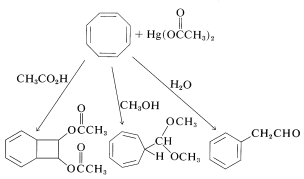
Las diversas formas en las que el ciclooctatetraeno puede reaccionar con un reactivo dado en diferentes condiciones se ilustran bien por la variedad de productos obtenidos con etanoato mercúrico en ácido etanoico, metanol y agua:
Los esfuerzos para preparar el “pentaleno”, un análogo puenteado del ciclooctatetraeno, no han tenido mucho éxito hasta el momento. Una sustancia que parece ser un metilpentaleno se ha caracterizado\(-180^\text{o}\) por sus propiedades espectrales. Al\(-105^\text{o}\) calentarlo forma un dímero.
Anular
El ciclooctatetraeno no es planar. Una razón es que la deformación angular es severa en la forma plana. ¿Es posible que los polialquenos conjugados de anillos más grandes puedan tener estructuras planas sin tensión? Los modelos muestran que se puede lograr una estructura sin tensión con dos o más de los dobles enlaces solo en configuraciones trans, y luego solo con un anillo lo suficientemente grande como para que los hidrógenos “internos” no interfieran entre sí.
Al discutir compuestos de este tipo, será conveniente usar el nombre [n] anuleno para designar los polialquenos cíclicos conjugados simples, con n refiriéndose al número de carbonos en el anillo, siendo el benceno [6] anuleno. La poliolefina cíclica conjugada más simple que podría tener un anillo plano sin deformación que contiene dobles enlaces trans, excepto las interferencias entre los hidrógenos internos, es [10] anuleno:
Es probable que las interferencias internas de hidrógeno sean de alguna importancia en todos los anillos hasta [30] anuleno. Muchos anulenos han sido sintetizados por F. Sondheimer.
Ya hemos mencionado (Sección 22-3C) las grandes diferencias en los desplazamientos químicos de RMN entre los hidrógenos internos y externos de [18] anuleno, sustancia que con 18\(\pi\) electriones debe ser aromática por\(4n + 2\) regla. Estas diferencias se observan sólo a bajas temperaturas. El espectro de RMN protónica de [18] anuleno a temperatura ambiente es una resonancia única, lo que indica que los\(\left( \ce{H}_b \right)\) hidrógenos internos\(\left( \ce{H}_a \right)\) y externos se están equilibrando rápidamente. Esto puede tener lugar solo si se produce la interconversión cis-trans sobre los dobles enlaces (marcados\(c\) y\(t\)):
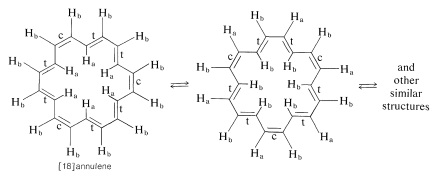
A bajas temperaturas, este equilibrio es lo suficientemente lento como para que se puedan discernir grupos separados de resonancias para los hidrógenos internos y externos en un experimento de RMN (ver Secciones 9-10C y 27-2).
Una predicción teórica que ha sido sustentada por el experimento es que un anillo con\(4n\)\(\pi\) electrones debe tener una circulación paramagnética de electrones, es decir, opuesta en dirección a la que se muestra en la Figura 22-4 para el benceno. Por ejemplo, [16] el anillo, que tiene\(4n\) electrones, no es muy estable y existe como una mezcla de interconversión muy rápida de dos isómeros configuracionales:
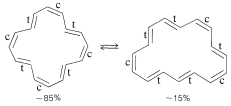
A temperaturas muy bajas\(\left( -155^\text{o} \right)\), el espectro de RMN de protones muestra los hidrógenos internos en\(\delta 12.9\) -\(10.5\) y los hidrógenos externos en\(\delta 5.7\) -\(6.4\), que es exactamente en el orden opuesto a los desplazamientos con [18] anuleno y los otros anillos\(\left[ 4n + 2 \right]\)\(\pi\) de electrones conocidos .
Los anulenos generalmente no son compuestos estables, pero los\(\left[ 4n + 2 \right]\) anulenos muestran claramente reacciones aromáticas típicas. Por ejemplo, [18] el anillo se ha convertido en los derivados nitro, etanoilo, bromo y carbaldehído mediante reacciones de sustitución electrófila.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


