23.4: Propiedades Físicas de las Aminas
- Page ID
- 72580
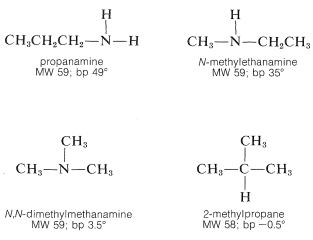
Las propiedades físicas de las aminas dependen de manera importante del grado de sustitución en nitrógeno. Así, las aminas primarias\(\ce{RNH_2}\), y las aminas secundarias\(\ce{R_2NH}\), son menos volátiles que los hidrocarburos de tamaño, peso y forma similares, como muestran los siguientes ejemplos:

Esto se debe a que las aminas están asociadas a través de enlaces de hidrógeno del tipo\(\ce{N-H} \cdots \colon \ce{N}\). Generalmente,\(\ce{N-H} \cdots \colon \ce{N}\) los enlaces son algo más débiles que los de los tipos correspondientes,\(\ce{O-H} \cdots \colon \ce{O}\) y\(\ce{F-H} \cdots \colon \ce{F}\), debido a que la electronegatividad del nitrógeno es menor que la del oxígeno o el flúor, haciendo del nitrógeno un donante de hidrógeno más pobre. Aun así, la asociación a través de enlaces de hidrógeno es significativa en aminas del tipo\(\ce{RNH_2}\) o\(\ce{R_2NH}\) como muestra la comparación del punto de ebullición. Con las aminas terciarias, donde no es posible la\(\ce{N-H} \cdots \colon \ce{N}\) unión, los puntos de ebullición son mucho más bajos y son similares a los de los hidrocarburos de ramificación y pesos moleculares similares:
Las solubilidades en agua de las aminas de menor peso molecular son apreciables, como se puede observar a partir de los datos de solubilidad en el Cuadro 23-1. De hecho, las aminas son más solubles en agua que los alcoholes de pesos moleculares similares. Este es el resultado de los enlaces de hidrógeno, con moléculas de amina como aceptores de hidrógeno y moléculas de agua como donantes de hidrógeno:

Los enlaces de hidrógeno de este tipo son más fuertes que\(\ce{O} \colon \cdots \ce{H-O-H}\) los enlaces.
Las aminas, especialmente aquellas con volatilidad significativa, tienen olores desagradables. Algunos de ellos huelen a amoníaco, otros huelen a pescado, mientras que otros son indescriptiblemente asquerosos. Las alcanediaminas de estructura\(\ce{H_2N(CH_3)}_n \ce{NH_2}\) son notablemente miserables y dos se llaman acertadamente putrescina\(\left( n = 4 \right)\) y cadaverina\(\left( n = 5 \right)\). Como puedes adivinar por los nombres, estos compuestos se encuentran entre las aminas producidas por la descomposición bacteriana de la materia orgánica animal (putrefacción de proteínas) y son componentes venenosos (ptomaínas) de la misma.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


