23.6: Estereoquímica de las aminas
- Page ID
- 72537
En amoníaco y aminas, los enlaces al nitrógeno son piramidales con ángulos de enlace más cercanos al valor tetraédrico de\(109.5^\text{o}\) que al\(90^\text{o}\) valor esperado para el uso de\(p\) orbitales puros de nitrógeno en la formación de enlaces. Consideramos que el nitrógeno en las aminas se formula mejor con orbitales de\(sp^3\) tipo híbrido; tres de estos orbitales se utilizan en la formación\(\sigma\) de enlaces, mientras que el cuarto contiene el par de electrones no enlazantes:

Una consecuencia de la configuración piramidal en nitrógeno es que, cuando los grupos unidos\(\ce{R}_1\)\(\ce{R}_2\), y\(\ce{R}_3\) son no identicos, el nitrógeno se convierte en un átomo quiral. En estas circunstancias, esperaríamos dos configuraciones enantioméricas:
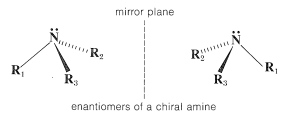
La resolución de una amina quiral acíclica en sus enantiómeros separados aún no se ha logrado, y parece que los enantiómeros se interconvierten muy rápidamente mediante un proceso de inversión que implica un estado de transición plano:
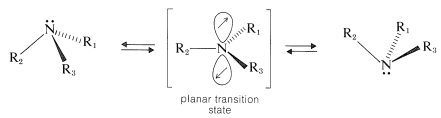
Con amoníaco, la inversión de este tipo ocurre aproximadamente\(4 \times 10^{10}\) veces por segundo a temperatura ambiente, lo que corresponde a que el estado plano sea menos estable que el estado piramidal en aproximadamente\(6 \: \text{kcal mol}^{-1}\). Con aminas terciarias alifáticas, la tasa de inversión es más del orden de\(10^3\) a\(10^5\) veces por segundo. Tales velocidades de inversión son muy grandes para permitir la resolución de una amina en sus enantiómeros mediante técnicas actualmente disponibles.
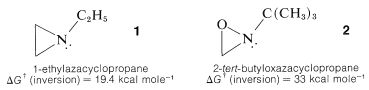
Cuando el nitrógeno de la amina se incorpora en un anillo pequeño, como en los azaciclopropanos\(1\), la velocidad de inversión en nitrógeno es marcadamente más lenta que en las aminas de cadena abierta. De hecho, con algunos oxazaciclopropanos, tales como\(2\), la inversión no ocurre rápidamente a temperaturas ordinarias, lo que significa que la configuración en el nitrógeno persiste el tiempo suficiente para que la resolución en enantiómeros sea posible:
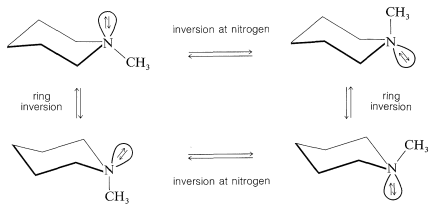
La estereoquímica de los azaciclohexanos se complica por el hecho de que hay un cambio conformacional en el anillo así como inversión en el nitrógeno piramidal. Por lo tanto, es difícil decir si el equilibrio axial-ecuatorial de, por ejemplo, 1-metilazaciclohexano se logra mediante inversión de anillo, o por inversión de nitrógeno, o ambas:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


