23.7: Aminas como bases
- Page ID
- 72578
Expresiones estándar de fuerza base
Quizás la propiedad más característica de las aminas es su capacidad para actuar como bases aceptando protones de una variedad de ácidos:
\[\ce{RNH_2} + \ce{HA} \rightleftharpoons \ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} + \overset{\ominus}{\ce{A}}\]
Cuando el ácido de referencia,\(\ce{HA}\) es agua, podemos establecer una escala de resistencias base a partir de la constante de equilibrio,\(K_b\), medida para la reacción de transferencia de protones mostrada en la Ecuación 23-3:
\[\ce{RNH_2} + \ce{H_2O} \overset{K_b}{\rightleftharpoons} \ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} + \overset{\ominus}{\ce{O}} \ce{H} \tag{23-3}\]
En muchos trabajos de referencia, es costumbre expresar las fortalezas de las bases orgánicas no como\(K_b\) sino como las constantes ácido-disociación,\(K_a\) (o\(K_a\) p's) para los ácidos conjugados correspondientes. Estos\(K_a\) valores son entonces las constantes ácidas de los iones amonio correspondientes en solución acuosa (Ecuación 23-4):
\[\ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} + \ce{H_2O} \overset{K_a}{\rightleftharpoons} \ce{RNH_2} + \overset{\oplus}{\ce{H_2O}} \tag{23-4}\]
Con esta convención, cuanto más fuerte sea la base\(\ce{RNH_2}\), mayor será el equilibrio en la Ecuación 23-4 a la izquierda, y más pequeño será\(K_a\). La relación entre\(K_a\) y\(K_b\) en solución de agua es
\[K_a \times K_b = 10^{-14}\]
y en términos de\(K\) valores p, porque por definición p\(K = -\text{log} K\),
p\(K_a\)\(+\) p\(K_b\)\(= 14\)
Fortalezas básicas de alcanaminas y cicloalcanaminas
Las resistencias básicas de las alcanaminas simples generalmente están alrededor\(K_b = 10^{-4}\)\(\left( K_a = 10^{-10} \right)\) en solución acuosa, y varían dentro de quizás un factor de 10 desde amoníaco hasta aminas primarias, secundarias y terciarias, como se puede ver a partir de los datos del Cuadro 23-1. La ciclohexanamina tiene aproximadamente la misma fuerza base que la metanamina, mientras que el efecto sobre el nitrógeno básico de estar en un anillo saturado, como en el azaciclohexano, aumenta algo la resistencia de la base.
Las tendencias que son evidentes, especialmente a partir de las basicidades de aminas medidas en fase gaseosa, apuntan a aumentar la basicidad con el número y tamaño de los grupos alquilo en el átomo de nitrógeno.
Orden de basicidad (fase gaseosa):\(\ce{(CH_3)_3N} > \ce{(CH_3)_2NH} > \ce{CH_3NH_2} > \ce{NH_3}\)
Esto es razonable porque es probable que los ácidos conjugados\(\ce{R_3} \overset{\oplus}{\ce{N}} \ce{H}\),, sean estabilizados por grupos alquilo donadores de electrones y polarizables, haciendo así\(\ce{R_3N}\) una base más fuerte. Que la misma tendencia no sea evidente en solución acuosa nuevamente muestra la influencia del disolvente en las propiedades termoquímicas (ver Sección 11-8A).
Generalmente, los sustituyentes localizados en grupos saturados unidos al nitrógeno influyen en las resistencias de las bases a través de sus efectos inductivos de la misma manera que estos sustituyentes influyen en las fuerzas de los ácidos carboxílicos (ver Sección 18-2).
Fortalezas Base de Arenaminas
Las alquenaminas, o enaminas\(\ce{R-CH=CHNH_2}\), generalmente no son estables y se reordenan fácilmente a iminas (Sección 16-4C). Una excepción importante es la bencenamina (anilina)\(\ce{C_6H_5NH_2}\), que tiene un grupo amino unido a un anillo de benceno. La estructura imina es menos favorable en virtud de la considerable energía de estabilización del anillo aromático:
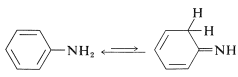
Por el calor de combustión de la bezenamina sabemos que tiene una energía de estabilización\(3 \: \text{kcal mol}^{-1}\) mayor que el benceno (Cuadro 21-1). Esta diferencia en las energías de estabilización se puede atribuir en la teoría de enlace de valencia o molecular-orbital a la deslocalización del par de electrones no compartidos en nitrógeno sobre el anillo de benceno. Las estructuras de enlace de valencia son
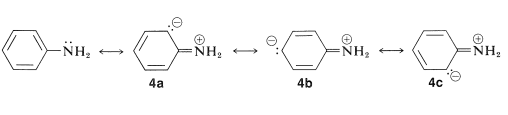
La energía extra\(3\) -\(\text{kcal mol}^{-1}\) estabilización de la bencenamina se puede explicar en términos de las estructuras\(4a\) a\(4c\).
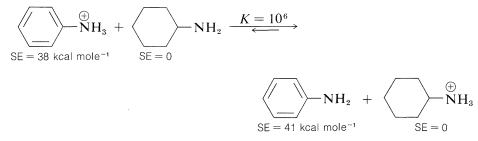
La benzenamina es solo 1/1,000,000 de una base tan fuerte como la ciclohexanamina. La mayor parte, si no la totalidad, de la diferencia puede explicarse por la disminución en la estabilización cuando el par de electrones no compartidos de nitrógeno se localiza en la formación de un\(\ce{N-H}\) enlace. De ahí que la bencenamina se estabilice más en el estado no ionizado por deslocalización electrónica, con relación a la ciclohexanamina, que en el estado ionizado, expresado por el siguiente equilibrio que se encuentra más a la derecha:
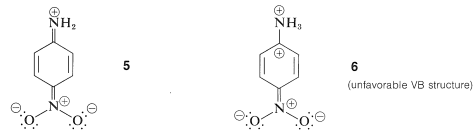
De acuerdo con las estructuras de enlace de valencia\(4a\),\(4b\), y\(4c\), la bencenamina tiene cierto grado de carácter de doble enlace entre el nitrógeno y el anillo, y cierto grado de carga negativa en las posiciones orto y para. Por consiguiente, la capacidad del nitrógeno amínico para añadir un protón debería ser particularmente sensible a los efectos eléctricos producidos por la presencia de grupos sustituyentes en el anillo aromático. Por ejemplo, sustituyentes carbonilo, nitro, ciano y etoxicarbonil, que pueden deslocalizar un par de electrones en un carbono adyacente (ver Secciones 17-1A, 17-3E y\ (\ alfa\) Carbono de Derivados de Acidos Carboxílicos” href=” /Librerías/Química orgánica/Libro:_Basic_principles_of_ Organic_Chemistry_ (Roberts_and_caserio) /18:_carboxilic_acids_and_su_derivativos/18.09:_reacciones_at_el/ (/alpha/) _carbons_of_carboxilic_acid_derivados #18 -8B_The_Claisen_Condensation">18-8B), se espera que reduzcan la fuerza base del nitrógeno de la amina cuando se sustituya en el orto o para posiciones. La razón es que la estabilización por el sustituyente, como lo demuestra la estructura\(5\) para 4-nitrobencenamina, es importante para la base libre y no para el ácido conjugado,\(6\):
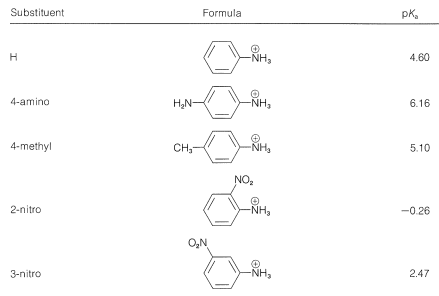
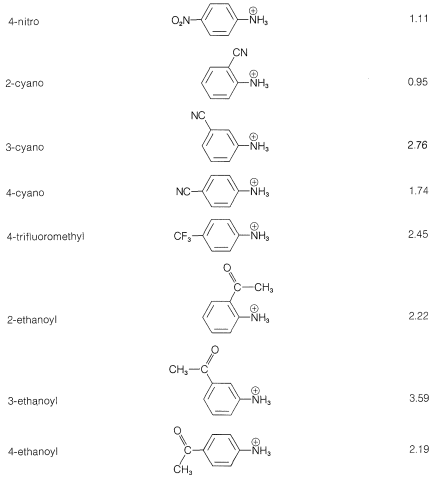
Es una práctica más simple y común discutir los efectos de los sustituyentes sobre la fuerza de base en términos de los equilibrios de disociación de los ácidos conjugados,\(\ce{ArNH_3^+} + \ce{H_2O} \rightleftharpoons \ce{ArNH_2} + \ce{H_3O^+}\). Los sustituyentes que pueden estabilizar la base libre por deslocalización electrónica o inducción, como en\(5\), tenderán a aumentar la disociación ácida de\(\ce{ArNH_3^+}\) (disminuir la fuerza base de\(\ce{ArNH_2}\)). Esto lo vemos en los datos del Cuadro 23-3 para los grupos aceptores de electrones (\(\ce{NO_2}\),,\(\ce{CN}\),\(\ce{CH_3CO}-\))\(\ce{CF_3}\), que aumentan las fuerzas ácidas, y para los grupos donadores de electrones (\(\ce{CH_3}\),\(\ce{NH_2}\)), que disminuyen las fuerzas ácidas. El efecto es más pronunciado cuando los grupos están en las posiciones orto o para (2 o 4).
Cuadro 23-3: Fortalezas de los Acidos Conjugados de Bencenaminas Monosustituidas en Solución Acuosa a\(25^\text{o}\)
Aminas no saturadas. Azarenes
Se encuentran diferencias sustanciales en la fuerza de base entre alcanaminas y aminas insaturadas que tienen el grupo\(\ce{-C=N}-\). Un ejemplo es azabenzeno (piridina,\(\ce{C_5H_5N}\)), que es un análogo de nitrógeno del benceno:
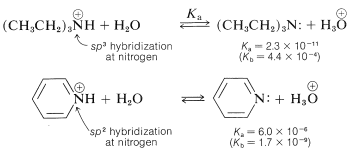
El azabenzeno es una base bastante débil - de hecho, es 1/100,00 una base tan fuerte como las alcanaminas típicas. Esta baja basicidad puede atribuirse a la hibridación de los orbitales de nitrógeno\(\left( sp^2 \right)\) en azabenzeno. Como indicamos en la Sección 11-8B en relación con la\(\ce{C-H}\) acidez, cuanto más\(s\) carácter en el orbital de\(\ce{C-H}\) unión, mayor será la acidez. Los mismos argumentos se mantienen para\(\ce{N-H}\) los enlaces en los ácidos conjugados\(\ce{-C=} \overset{\oplus}{\ce{N}} \ce{H}-\),, como muestran los siguientes datos:
Otros ejemplos incluyen:
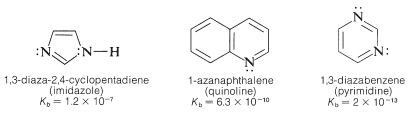
Es incorrecto suponer que la basicidad del nitrógeno insaturado en un\(\ce{C=N}-\) grupo es siempre baja. Considere, por ejemplo, la fuerza base de 2,2-diaminoazaeteno (guanidina):
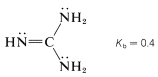
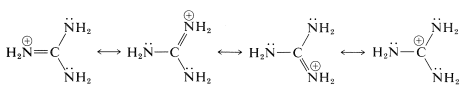
Esta sustancia es la base organonitrógeno eléctricamente neutra más fuerte conocida. El nitrógeno básico es el\(\left( sp^2 \right)\) iminonitrógeno, que en la protonación forma un ácido conjugado particularmente estable en el que los tres\(\ce{NH_2}\) grupos se vuelven idénticos debido a la deslocalización de electrones:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


