23.9: Aminas como nucleófilos
- Page ID
- 72598
Acilación de Aminas. Síntesis de amidas
Los electrones no compartidos sobre el nitrógeno juegan un papel clave en las reacciones de las aminas. De hecho, casi todas las reacciones de aminas en el átomo de nitrógeno tienen, como primer paso, la formación de un enlace que involucra el par de electrones no compartidos sobre el nitrógeno. Un ejemplo típico es la acilación, que es la formación de amida a través de la reacción de un cloruro de acilo, un anhídrido o un éster con una amina. La etapa inicial en estas reacciones con derivados de bencenocarbonilo y metanamina como reactivos ilustrativos es como sigue:
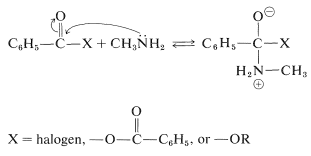
La reacción se completa con la pérdida de un protón y la eliminación de\(\ce{X}^\ominus\):
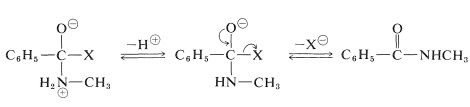
La reacción se llama acilación debido a que un grupo acilo,\(\ce{RCO}-\), se transfiere al nitrógeno de la amina. Se verá que estas reacciones son muy similares a la formación de ésteres por agentes acilantes, por lo que el grupo acilo se transfiere al oxígeno de un alcohol (Sección 15-4D):
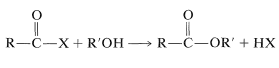
Una seria desventaja de la preparación de amidas a través de la reacción de una amina con un cloruro de acilo (o anhídrido) es la formación de un mol de sal de amina por cada mol de amida:
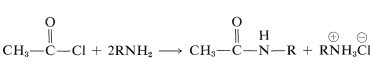
Esto es especialmente grave si la amina es el ingrediente caro en la reacción. En tales circunstancias, la reacción generalmente se lleva a cabo en un sistema de dos fases con el cloruro de acilo y la amina en la fase no acuosa e hidróxido de sodio en la fase acuosa. A medida que la sal de amina se forma y se disuelve en el agua, se convierte de nuevo en amina por el hidróxido de sodio y se extrae de nuevo a la fase no acuosa:
\[\ce{R} \overset{\oplus}{\ce{N}} \ce{H_3} \overset{\ominus}{\ce{Cl}} + \overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{OH}} \rightarrow \ce{RNH_2} + \overset{\oplus}{\ce{Na}} \overset{\ominus}{\ce{Cl}} + \ce{H_2O}\]
Este procedimiento requiere un exceso de cloruro de ácido debido a que parte del mismo se desperdicia por hidrólisis.
Formación de imina y enamina
Las aminas también se suman al carbono carbonílico de aldehídos y cetonas, pero las reacciones toman un curso diferente al de la acilación y, con amoníaco o una amina primaria, producen iminas\(\ce{-C=N-R}\), como se discutió anteriormente en la Sección 16-4C.
Las iminas formadas a partir de amoníaco y aldehídos\(\left( \ce{RCH=NH} \right)\) son muy inestables y se polimerizan fácilmente (Sección 16-4C). Sin embargo, la sustitución de un grupo alquilo o arilo en el nitrógeno aumenta la estabilidad, y las iminas\(\ce{N}\) -sustituidas,\(\ce{-C=N-R}\), son conocidas familiarmente como bases de Schiff. Son intermedios clave en una serie de reacciones sintéticas y biológicas (ver, por ejemplo, 17-3F) y son capaces de reordenarse por transferencia reversible de protones que, en algunos aspectos, se asemeja al reordenamiento de cetonas a enoles:
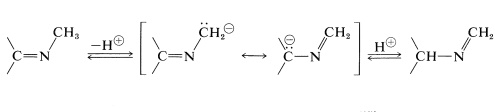
Las aminas secundarias no pueden formar iminas con aldehídos y cetonas, sino que pueden reaccionar para formar enaminas,\(\ce{-C=C-NR_2}\). La formación y usos sintéticos de estos compuestos se discutieron previamente (Secciones 16-4C, 17-4B y 18-9D).
Formación de sulfonamida a partir de aminas
Hemos visto que las aminas reaccionan con cloruros de acilo para dar amidas. Una reacción muy similar ocurre con los cloruros de sulfonilo para dar sulfonamidas. Un ejemplo es cloruro de bencenosulfonilo que reacciona con metanamina para dar\(\ce{N}\) -metilbencenosulfonamida:
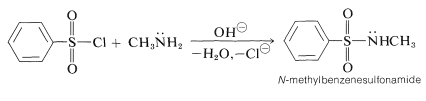
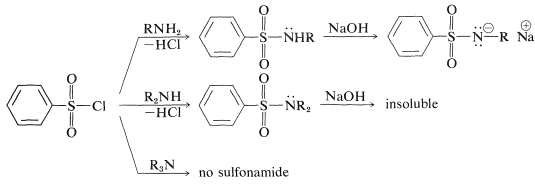
La sulfonilación de aminas puede ser una manera útil de diferenciar (químicamente) entre aminas primarias, secundarias y terciarias mediante lo que se conoce como la prueba de Hinsberg. Las aminas primarias y secundarias reaccionan con un cloruro de sulfonilo, pero solo la sulfonamida de las aminas primarias tiene\(\ce{N-H}\) hidrógeno. El grupo sulfonilo hace que este hidrógeno sea relativamente ácido y, por lo tanto, la sulfonamida se disuelve fácilmente en soluciones de hidróxido de sodio. La amina secundaria no da una amida soluble en base, mientras que la amina terciaria no da sulfonamida:
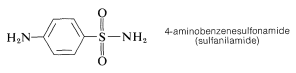
Las sulfonamidas tienen valor medicinal como agentes antibacterianos. De hecho, la 4-aminobencenosulfonamida fue el primer fármaco antibacteriano sintético en uso clínico, y es eficaz contra un gran número de infecciones bacterianas:
Esta sustancia inhibe el crecimiento de bacterias al interferir con la síntesis del ácido fólico\(7\), que es una sustancia esencial tanto para bacterias como para animales. Sin embargo, los animales adquieren ácido fólico de una dieta normal, mientras que las bacterias tienen que sintetizarlo. La biosíntesis del ácido fólico está bloqueada por la 4-aminobencenosulfonamida, probablemente por la similitud estructural de la sulfonamida con el ácido 4-aminbenzoico, que es un ingrediente normal en la biosíntesis del ácido fólico. El sistema enzimático involucrado aparentemente sustituye la sulfonamida por el ácido aminbenzoico y crea un ácido fólico tipo sulfonamida en lugar del derivado de carboxamida (comparar estructuras\(7\) y\(8\)):
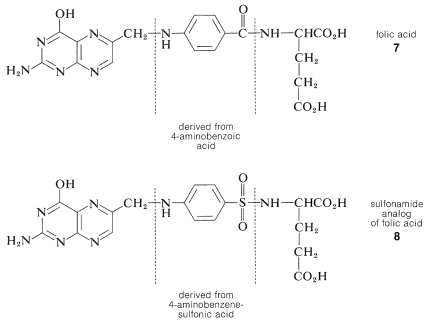
Se han sintetizado unas 10.000 sulfonamidas estructuralmente diferentes como resultado del descubrimiento de las propiedades antibacterianas de la sulfanilamida. La práctica de sintetizar numerosos compuestos estructuralmente relacionados en un esfuerzo por encontrar algunos que sean más eficientes o tengan menos efectos secundarios que los ya disponibles es muy importante para la industria farmacéutica. Sin embargo, como suele ser el caso, de las muchas sulfonamidas conocidas solo alrededor de treinta tienen el equilibrio adecuado de cualidades para ser clínicamente útiles.
Alquilación. Síntesis de alcanamidas
El amoníaco y las aminas pueden funcionar como nucleófilos en reacciones de\(S_\text{N}2\) desplazamiento de haluros de alquilo (Sección 8-7E). Dichos procesos proporcionan síntesis de alcanaminas solo con aquellos haluros que son reactivos en\(S_\text{N}2\) pero no\(E2\) reacciones. Por ejemplo,
\[\ce{NH_3} + \ce{CH_3-I} \overset{S_\text{N}2}{\longrightarrow} \ce{CH_3-NH_3^+} \ce{I^-} \tag{23-5}\]
El producto formado de acuerdo con la Ecuación 23-5 es una sal de amonio a partir de la cual se puede recuperar la amina parental por neutralización con una base fuerte, tal como hidróxido de sodio:
\[\ce{CH_3NH_3^+} \ce{I^-} + \ce{Na^+} \ce{^-OH} \rightleftharpoons \ce{CH_3NH_2} + \ce{Na^+} \ce{I^-} + \ce{H_2O} \tag{23-6}\]
Los equilibrios ácido-base similares a la Ecuación 23-6 también ocurren entre una sal de amonio y una amina neutra (Ecuación 23-7). Esto puede tener graves consecuencias en las alquilaciones de aminas porque puede conducir a mezclas de productos, por lo que más de un grupo alquilo está unido al nitrógeno:
\[\begin{align} \ce{CH_3NH_3^+} \ce{I^-} + \ce{NH_3} &\rightleftharpoons \ce{CH_3NH_2} + \ce{NH_4^+} \ce{I^-} \\ \ce{CH_3NH_2} + \ce{CH_3-I} &\rightarrow \ce{(CH_3)_2CH_2^+} \ce{I^-} \end{align} \tag{23-7}\]
Por lo tanto, podemos esperar que la reacción del amoníaco con yoduro de metilo dé cuatro posibles productos de alquilación, mono-, di- y trimetilaminas, así como yoduro de tetrametilamonio:
\[\ce{NH_3} \underset{-\ce{HI}}{\overset{\ce{CH_3I}}{\longrightarrow}} \ce{CH_3NH_2} \underset{-\ce{HI}}{\overset{\ce{CH_3I}}{\longrightarrow}} \ce{(CH_3)_2NH} \underset{-\ce{HI}}{\overset{\ce{CH_3I}}{\longrightarrow}} \ce{(CH_3)_3N} \overset{\ce{CH_3I}}{\longrightarrow} \ce{(CH_3)_4N}^\oplus \ce{I}^\ominus\]
A pesar de que las reacciones de alquilación de aminas generalmente dan mezclas de productos, son de valor práctico a escala industrial. La síntesis comercial de metanaminas utiliza metanol como agente metilante y óxido de aluminio como catalizador ácido; las tres aminas se forman, y se separan por destilación y extracción. La función del catalizador es hacer\(\ce{OH}\) un mejor grupo de salida (Sección 8-7D):
\[\ce{CH_3OH} + \ce{NH_3} \underset{450^\text{o}, \: 200 \: \text{psi}}{\overset{\ce{Al_2O_3}}{\longrightarrow}} \ce{CH_3NH_2} + \ce{(CH_3)_2NH} + \ce{(CH_3)_3N} + \ce{H_2O}\]
Los haluros de tetraalquilamonio formados por la alquilación completa de aminas son compuestos iónicos que se asemejan a sales de metales alcalinos. Cuando se usa óxido de plata para precipitar el ion haluro, los haluros de tetraalquilamonio se convierten en hidróxidos de tetraalquilamonio, que son sustancias fuertemente básicas similares al hidróxido de sodio o potasio:
\[\ce{(CH_3)_4} \overset{\oplus}{\ce{N}} \: \overset{\ominus}{\ce{I}} \underset{-\ce{AgI}}{\overset{\ce{Ag_2O}, \: \ce{H_2O}}{\longrightarrow}} \ce{(CH_3)_4} \overset{\oplus}{\ce{N}} \: \overset{\ominus}{\ce{OH}}\]
Los hidróxidos de alquilamonio de mayor peso molecular se descomponen al calentarse para dar alquenos. La reacción es un método estándar para la preparación de alquenos y se conoce como eliminación de Hofmann (ver Sección 8-8B):
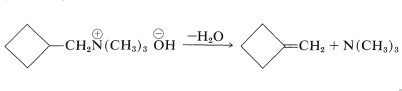
En principio, existen los mismos problemas de polialquilación y\(E2\) eliminación con el anión amina que con la amina neutra -y hasta donde\(E2\) va, mucho más.
Existen aniones nitrogenados que son útiles en las reacciones de alquilación, pero se derivan de carboxamidas y sulfonamidas en lugar de aminas. Aquí se dan dos ejemplos para ilustrar la síntesis de una amina primaria y una secundaria (ver también la Sección 18-10C):
Gabriel síntesis de aminas primarias
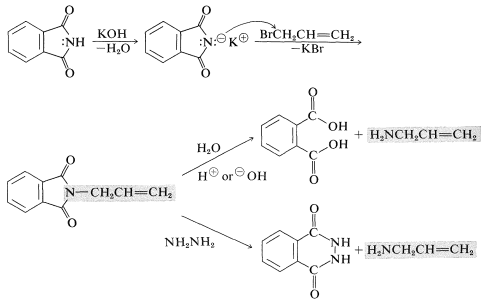
El éxito de la síntesis de Gabriel depende de que la\(\ce{N}\) -alquilación sea favorecida sobre la\(\ce{O}\) -alquilación y\(S_\text{N}2\) favorecida sobre\(E2\). Los disolventes polares apróticos como el metilsufinilmetano\(\ce{(CH_3)_2SO}\), son útiles para la síntesis de Gabriel. La hidrólisis del producto de alquilación a menudo es difícil y el “intercambio de amida” (análogo al intercambio de éster, Sección 18-7A) con hidrazina puede ser una manera efectiva de liberar la amina de la imida.
Síntesis de sulfonamidas de aminas secundarias
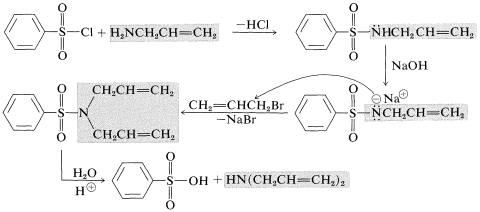
En esta síntesis, las propiedades ácidas de las sulfonamidas del tipo\(\ce{C_6H_5SO_2NHR}\) se utilizan para formar aniones capaces de alquilación por el\(S_\text{N}2\) mecanismo.
Arilación. Síntesis de Arenaminas
En discusiones anteriores (Sección 14-6A) afirmamos que no es posible desplazar halógeno de haluros de arilo simples como el bromobenceno mediante\(S_\text{N}2\) reacciones simples usando aminas u otros nucleófilos débilmente básicos a temperaturas ordinarias:
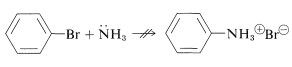
Sin embargo, la arilación con tales sistemas ocurrirá con bases fuertes por el mecanismo bencino (Secciones 14-6C y 23-8).
La arilación de aminas por desplazamiento directo de haluros de arilo es posible cuando el halógeno es activado por fuertes grupos aceptores de electrones en las posiciones orto y para. Por ejemplo, la 2,4-dinitrobencenamina se puede preparar calentando 2,4-dinitroclorobenceno con amoniaco:
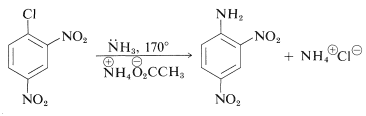
Las razones por las que procede esta reacción se discuten en detalle en la Sección 14-6B.
Arenaminas como Nucleófilos. Sustitución aromática electrofílica
El nitrógeno de las arenaminas es menos básico y menos nucleófilo que el nitrógeno de las alcanaminas debido a la deslocalización electrónica del par solitario de nitrógeno, como se muestra para la bencenamina en la Sección 23-7C. Las estructuras de enlace de valencia polar enfatizan que los átomos del anillo, particularmente las posiciones orto y para, deben ser más nucleofílicos que en benceno. En consecuencia, el grupo amino activa fuertemente el anillo hacia el ataque por electrófilos. De hecho, el bromo reacciona rápidamente con bencenamina en solución acuosa para introducir tres sustituyentes bromo y formar 2,4,6-tribromobencenamina; no se requiere catalizador:

Los reactivos débilmente electrófilos que normalmente no atacan al benceno atacarán los carbonos del anillo de las arenaminas. Algunas de esas reacciones se describen más adelante en el capítulo (Secciones 23-10C y 23-10D).
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


