23.10: Aminas con ácido nitroso
- Page ID
- 72536
Alcanaminas con ácido nitroso
Algunas de las reacciones más importantes de las aminas son provocadas por el ácido nitroso\(\left( \ce{HONO} \right)\). El carácter de los productos depende mucho de si la amina es primaria, secundaria o terciaria. De hecho, el ácido nitroso es un reactivo útil para determinar si una amina particular es primaria, secundaria o terciaria. Con aminas primarias, el ácido nitroso da como resultado la evolución de gas nitrógeno; con aminas secundarias insolubles líquidos amarillos o compuestos sólidos\(\ce{N}\) -nitrosos\(\ce{R_2N-N=O}\),, separados; las alcanaminas terciarias se disuelven y reaccionan con soluciones de ácido nitroso sin desprendimiento de nitrógeno, generalmente para dar complejo productos:
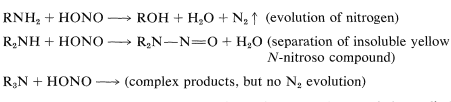
El ácido nitroso es inestable y siempre se prepara según sea necesario, generalmente mezclando una solución de nitrito de sodio,\(\ce{NaNO_2}\), con un ácido fuerte en\(0^\text{o}\). Estas condiciones proporcionan una fuente de\(^\oplus \ce{NO}\), que se transfiere fácilmente al nitrógeno nucleofílico de la amina:
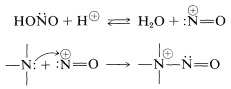
Con este paso clave común, ¿por qué las aminas reaccionan de manera diferente con el ácido nitroso dependiendo de su grado de sustitución? La respuesta se puede ver a partir de las reacciones que son más fácilmente posibles para el\(\ce{-} \overset{\oplus}{\ce{N}} \ce{-NO}\) intermedio. Claramente, si hay un hidrógeno en el nitrógeno positivo, se puede perder como un protón y se forma una\(\ce{N}\) -nitrosamina:
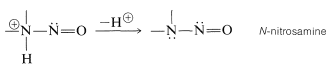
Con una amina secundaria, la reacción se detiene aquí, con formación de\(\ce{R_2N-NO}\), y debido a que estas sustancias son bases muy débiles, son insolubles en ácidos acuosos diluidos. Son característicamente sólidos o aceites de color amarillo o naranja-amarillo.
Un\(\cdot \overset{\oplus}{\ce{N}} \ce{O}\) complejo de amina terciaria\(\ce{R_3} \overset{\oplus}{\ce{N}} \ce{-NO}\),, no puede perder un protón del nitrógeno, sino que puede perder un protón del carbono y pasar a formar productos complejos.
Con una amina primaria, la\(\ce{N}\) -nitrosamina inicialmente formada puede sufrir un desplazamiento de protones por una secuencia análoga a la interconversión de una cetona en un enol. El producto se llama ácido diazoico:
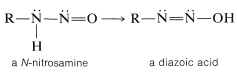
Algunos ácidos diazoicos forman sales que son bastante estables, pero los ácidos mismos suelen descomponerse rápidamente a iones diazonio:
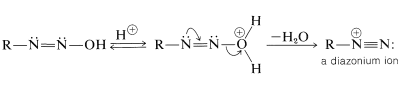
Las sales de diazonio pueden considerarse como combinaciones de carbocationes\(\ce{R}^\oplus\) con\(\ce{N_2}\) y, debido a la considerable estabilidad del nitrógeno en forma de\(\ce{N_2}\), esperaríamos que las sales de diazonio se descompongan fácilmente con la evolución del nitrógeno y la formación de carbocationes. Esta expectativa se realiza, y las sales de diazonio normalmente se descomponen de esta manera en solución acuosa. Los iones diazonio alifáticos se descomponen tan rápidamente que su presencia solo puede inferirse del hecho de que los productos son típicamente los de reacciones de carbocationes:
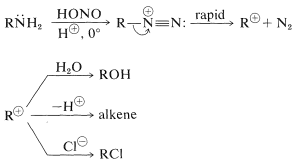
Con la propanamina, la pérdida de nitrógeno del ion diazonio da el catión propilo muy poco estabilizado, que luego experimenta una variedad de reacciones que son consistentes con las reacciones de carbocatión discutidas anteriormente (ver Secciones 8-9B y 15-5E):
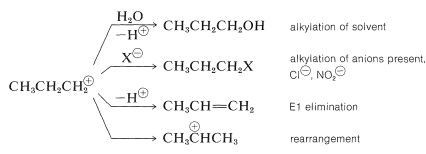
El catión isopropilo formado por reordenamiento se somete a sustitución y eliminación como el catión propilo. Alrededor de la mitad de los productos provienen de cationes isopropílicos.
Hay una reacción excepcional del catión propilo que implica 1,3-eliminación y formación de aproximadamente\(10\%\) de ciclopropano:
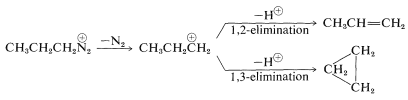
Claramente, la plétora de productos que se esperan, particularmente los resultantes de la transposición, evita que la reacción de las aminas primarias simples con ácido nitroso tenga alguna utilidad sintética sustancial.
Arenaminas con Ácido Nitroso. Sales de Arenediazonio
A diferencia de las alquilaminas primarias, las arenaminas primarias reaccionan con el ácido nitroso\(0^\text{o}\) para dar sales de diazonio que, en la mayoría de los casos, son lo suficientemente estables como para aislarse como\(\ce{BF_4^-}\) sales cristalinas. Otras sales pueden aislarse, pero algunas de estas, como el cloruro de bencenodiazonio, en estado sólido pueden descomponerse con violencia explosiva.
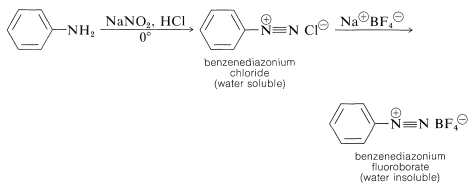
La razón de la mayor estabilidad de las sales de arenodiazonio en comparación con las sales de alcanodiazonio parece estar relacionada con la dificultad de formar carbocationes de arilo (Sección 14-6A). Incluso la ganancia de energía asociada a tener nitrógeno como grupo saliente no es suficiente para hacer que los cationes arilo se formen fácilmente, aunque la solvolisis de iones arenodiazonio en el agua procede por un\(S_\text{N}1\) mecanismo:
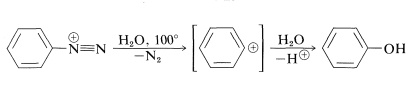
Esta reacción tiene utilidad general para el reemplazo de grupos amino aromáticos por grupos hidroxilo. En contraste con el comportamiento de las alquilaminas, no se producen reordenamientos.
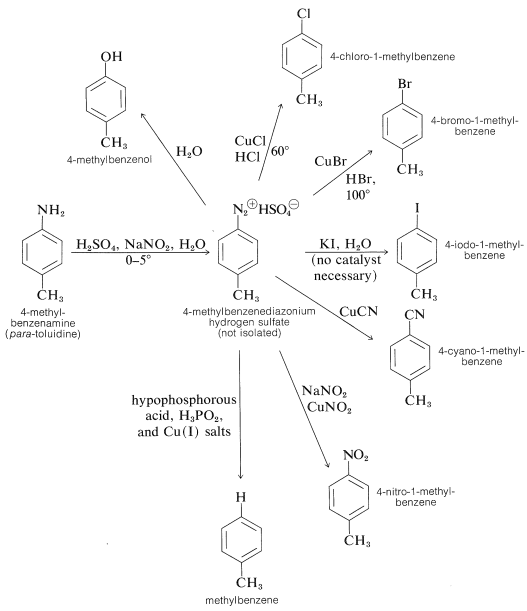
Generalmente, las sales de diazonio de arenaminas son intermedios mucho más útiles que las sales de diazonio de alcanaminas. De hecho, las sales de arenodiazonio proporcionan las únicas sustancias que experimentan reacciones de sustitución nucleofílica en el anillo aromático en condiciones suaves, sin la necesidad de tener grupos activantes, como nitro o ciano, en la posición orto o para. Las reacciones más importantes de este tipo incluyen la sustitución del grupo diazonio por nucleófilos como\(\ce{Cl}^\ominus\),,\(\ce{Br}^\ominus\),\(\ce{I}^\ominus\),\(\ce{CN}^\ominus\),\(\ce{NO_2^-}\), y estas reacciones conducen a la formación de compuestos arilhalógeno, ciano y nitro. La mayoría de estas reacciones requieren iones cuprosos,\(\ce{Cu}\) (I), como catalizadores. El método se conoce como la reacción de Sandmeyer. Los siguientes ejemplos ilustran cómo una arenamina primaria se puede convertir en una variedad de grupos diferentes por medio de su sal de diazonio:
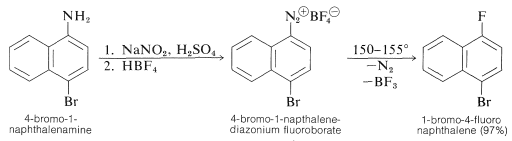
Los fluoruros de arilo también se pueden preparar a partir de arenaminas por medio de sales de diazonio si el procedimiento está ligeramente modificado. La amina se diazota con ácido nitroso de la manera habitual; luego se agrega ácido fluorobórico o una sal de fluoroborato, lo que generalmente provoca la precipitación de un fluoroborato de diazonio escasamente soluble. La sal se recoge y se seca completamente, luego se calienta cuidadosamente hasta el punto de descomposición, siendo los productos un fluoruro de arilo, nitrógeno y trifluoruro de boro:
\[\ce{C_6H_5} \overset{\oplus}{\ce{N}} \: \overset{\ominus}{\ce{BF_4}} \overset{\text{heat}}{\longrightarrow} \ce{C_6H_5F} + \ce{N_2} + \ce{BF_3}\]
Esta reacción se conoce como la reacción de Schiemann. A continuación se muestra un ejemplo (que da un rendimiento mejor de lo habitual):
Posteriormente en el capítulo veremos que las aminas se pueden preparar mediante la reducción de compuestos nitro, lo que permite la siguiente secuencia de reacciones:
\[\ce{ArH} \overset{\ce{HNO_3}}{\longrightarrow} \ce{ArNO_2} \overset{\left[ \ce{H} \right]}{\longrightarrow} \ce{ArNH_2} \overset{\ce{HONO}}{\longrightarrow} \ce{ArN_2^+} \underset{-\ce{N_2}}{\overset{\ce{CuX}}{\longrightarrow}} \ce{ArX}\]
Esta secuencia es especialmente útil para introducir grupos o producir orientaciones de sustituyentes que pueden no ser posibles por sustitución directa.
El grupo de reacciones Sandmeyer es un ejemplo de la producción de sustitución nucleofílica por medio de intermedios radicales (ver Sección 14-10A):
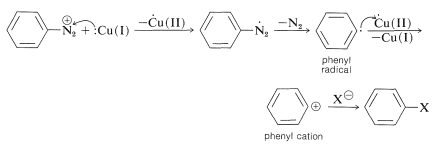
Este mecanismo se sustenta en el hecho de que\(\ce{Cu}\) (II) es importante en la formación de\(\ce{C_6H_5X}\). Si la concentración de\(\ce{Cu}\) (II) se mantiene muy baja para ralentizar la conversión de\(\ce{C_6H_5} \cdot\) a\(\ce{C_6H_5^+}\), y está presente un compuesto con un doble enlace reactivo, entonces los productos se forman por ataque o\(\ce{C_6H_5} \cdot\) sobre el doble enlace. Esto se llama la reacción de Meerwein:
\[\ce{C_6H_5} \overset{\oplus}{\ce{N_2}} \: \overset{\ominus}{\ce{X}} + \ce{CH_2=CHCN} \overset{\ce{Cu} \left( \text{I} \right)}{\longrightarrow} \ce{C_6H_5CH_2-CHXCN} + \ce{N_2}\]
El ion yoduro parece ser un agente reductor suficientemente bueno para formarse\(\ce{C_6H_5} \cdot\) sin la intervención de\(\ce{Cu}\) (I);\(\ce{I_2}\) generalmente se forma considerable en la reacción:
\[\begin{align} \ce{C_6H_5} \overset{\oplus}{\ce{N_2}} + \overset{\ominus}{\ce{I}} &\rightarrow \ce{C_6H_5} \cdot + \ce{N_2} + \ce{I} \cdot \\ \ce{C_6H_5} \cdot + \ce{I} \cdot &\rightarrow \ce{C_6H_5I} \\ 2 \ce{I} \cdot &\rightarrow \ce{I_2} \end{align}\]
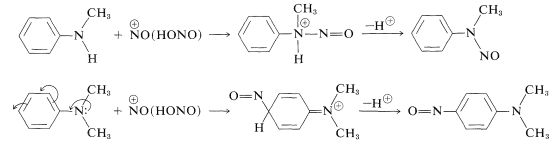
Las arenaminas secundarias reaccionan con ácido nitroso para formar compuestos\(\ce{N}\) nitrosos mientras que las arenaminas terciarias experimentan sustitución electrófila con\(\ce{NO}^\oplus\) si tienen una posición para no sustituida:
Reacciones de Acoplamiento Diazo
No todas las reacciones de los iones diazonio implican la escisión del\(\ce{C-N}\) enlace. Un grupo importante de reacciones de iones arenodiazonio implica la sustitución aromática por el ion diazonio que actúa como un agente electrófilo para producir compuestos azoicos,\(\ce{Ar-N=N-Ar}\):
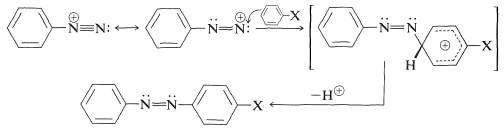
Esta reacción es altamente sensible a la naturaleza del sustituyente\(\ce{X}\), y el acoplamiento a derivados de benceno normalmente ocurre solo cuando\(\ce{X}\) es un grupo fuertemente donador de electrones tal como\(\ce{-O}^\ominus\),\(\ce{-N(CH_3)_2}\), y\(\ce{-OH}\). Sin embargo, el acoplamiento con\(\ce{X} = \ce{-OCH_3}\) puede tener lugar con iones diazonio particularmente activos.
El acoplamiento diazo tiene un valor técnico considerable, debido a que los compuestos azo que se producen son altamente coloreados. Muchos se utilizan como tintes de tela y para otros fines de coloración. Un ejemplo típico de acoplamiento diazo es la formación de 4-\(\ce{N}\),\(\ce{N}\) -dimetilaminoazobenceno a partir de cloruro de bencenodiazonio y\(\ce{N}\),\(\ce{N}\) -dimetilbencenamina:
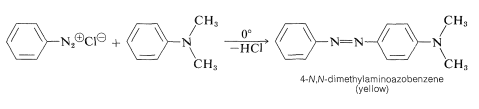
El producto alguna vez se utilizó para colorear grasas comestibles y por lo tanto se conocía como “Amarillo Mantequilla”, pero su uso para colorear alimentos está prohibido porque se informa que es un potente carcinógeno hepático para ratas.
El pH utilizado para el acoplamiento diazo de aminas es muy importante para determinar la naturaleza de los productos. En condiciones casi neutras, el ion diazonio puede atacar el nitrógeno de la arenamina en lugar de un carbono anular. En este caso se forma un compuesto diazoamino, un triazeno\(\ce{-N=N-N}-\),:
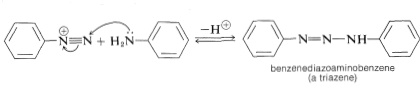
La reacción se invierte fácilmente si el pH se baja suficientemente.
Como se ve en esta breve discusión sobre las sales de arenediazonio, su química es compleja. Es inapropiado discutir aquí todas sus muchas reacciones, pero en la Tabla 23-4 se da un resumen de los tipos de reacciones más importantes.
Cuadro 23-4: Resumen de reacciones de sales de arenediazonio

.png)
Reordenamientos\(\ce{N}\) de Arenaminas Sustituidas
Una arenamina secundaria se comporta como una alcanamina secundaria al reaccionar con ácido nitroso para dar una\(\ce{N}\) -nitrosamina. Sin embargo, cuando se trata con un ácido, la\(\ce{N}\) -nitrosamina se reorganiza:
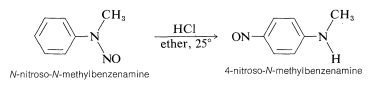
Este es un ejemplo de un grupo de reordenamientos formalmente relacionados en los que un sustituyente\(\ce{Y}\),, unido al nitrógeno de un derivado de bencenamina migra a las posiciones orto o para del anillo aromático bajo la influencia del ácido:
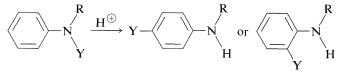
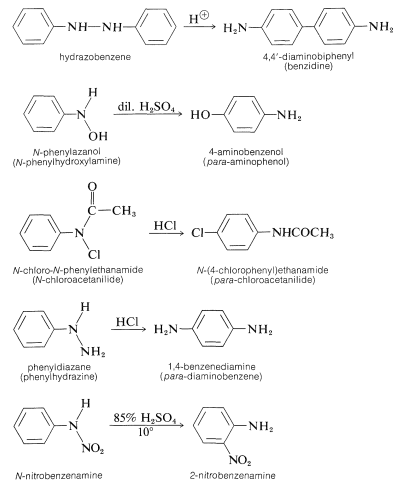
El reordenamiento ocurre más fácilmente cuando\(\ce{Y}\) es un grupo fuertemente atrayente de electrones y el\(\ce{N-Y}\) enlace que se rompe no es tan fuerte como el\(\ce{C-Y}\) enlace que se forma. Algunos de los muchos ejemplos de este tipo de reacción siguen:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


