23.11: Oxidación de Aminas
- Page ID
- 72646
Estados de oxidación del nitrógeno en compuestos orgánicos
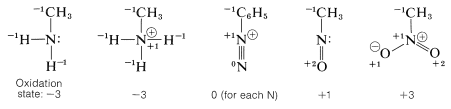
El nitrógeno tiene una amplia gama de estados de oxidación en compuestos orgánicos. Podemos llegar a una escala arbitraria para la oxidación del nitrógeno de la misma manera que lo hicimos para el carbono (Sección 11-1). Simplemente definimos nitrógeno elemental como el estado de oxidación cero, y cada átomo unido al nitrógeno contribuye -1 al estado de oxidación si es más electropositivo que el nitrógeno (por ejemplo\(\ce{H}\),\(\ce{C}\),\(\ce{Li}\),\(\ce{B}\),,\(\ce{Mg}\)) y +1 si es más electronegativo (por ejemplo\(\ce{O}\), \(\ce{F}\),\(\ce{Cl}\)). Los átomos doblemente unidos se cuentan dos veces, y una carga positiva formal asociada con el nitrógeno cuenta como +1.
Para ilustrar, los estados de oxidación de varios compuestos representativos son los siguientes:
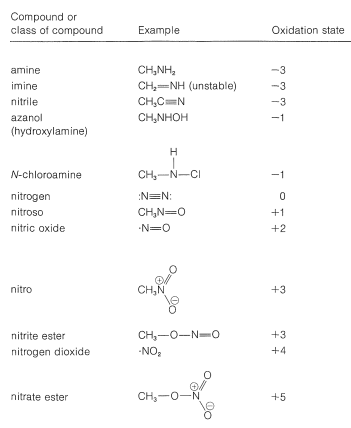
En la Tabla 23-5 se enumeran varios tipos de compuestos nitrogenados para ilustrar el rango de estados de oxidación que son posibles.
Cuadro 23-5: Estados de Oxidación del Nitrógeno
Oxidación de Aminas Terciarias Óxidos de amina
Para la oxidación de una amina terciaria por reactivos como el peróxido de hidrógeno\(\ce{H_2O_2}\), o ácidos peroxicarboxílicos\(\ce{RCOOOH}\), que pueden suministrar un átomo de oxígeno con seis electrones, el producto esperado es un óxido de azano (óxido de amina). Así\(\ce{N}\), la\(\ce{N}\) -dietiletanamina (trietilamina) se puede oxidar a óxido de trietilazano (óxido de trietilamina):
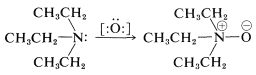
Los óxidos de amina son interesantes por dos razones. Primero, los óxidos de amina se descomponen cuando se calientan fuertemente, y esta reacción proporciona una preparación útil de alquenos. Con óxido de trietilazano (óxido de trietilamina), se forma eteno:
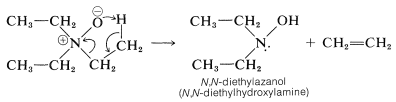
El segundo punto interesante sobre los óxidos de amina es que, a diferencia de las aminas, no experimentan una rápida inversión en el átomo de nitrógeno, y los óxidos de aminas con tres\(\ce{R}\) grupos diferentes son resolubles en formas ópticamente activas. Esto se ha logrado para varios óxidos de amina, incluyendo el de\(\ce{N}\) -etil-\(\ce{N}\) -metil-2-propanamina.
Oxidación de alcanaminas primarias y secundarias
Se podría esperar que la adición de un átomo de oxígeno de peróxido de hidrógeno o un peroxiácido a una amina primaria o secundaria produzca un intermedio de tipo óxido de amina, que luego podría reorganizarse a un azanol (hidroxilamina):
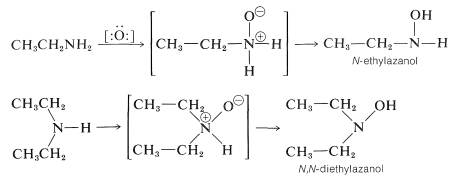
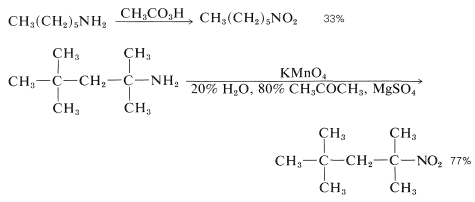
Sin embargo, estas oxidaciones suelen tomar un curso más complicado, porque los azanoles mismos se oxidan fácilmente, y en el caso de las aminas primarias, la oxidación ocurre hasta llegar a compuestos nitro, con rendimientos de justos a buenos:
Oxidación de aminas aromáticas
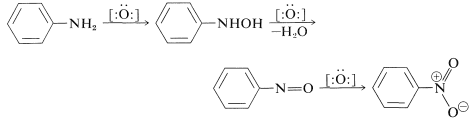
Se utilizará bencenamina para ilustrar algunas reacciones de oxidación típicas de las arenaminas. El curso de la oxidación depende de la naturaleza del agente oxidante y de la arenamina. Con peróxido de hidrógeno o ácidos peroxicarboxílicos, cada uno de los cuales funciona para donar oxígeno al nitrógeno, puede ocurrir oxidación al azanol, al nitroso o al compuesto nitro, dependiendo de la temperatura, el pH y la cantidad de agente oxidante:
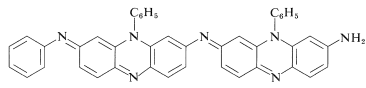
Los agentes oxidantes que abstringen un átomo de hidrógeno o ion hidruro conducen a reacciones más complejas, que a menudo resultan en productos altamente coloreados. Uno de los mejores tintes negros para tela (Aniline Black) se produce impregnando la tela con solución de cloruro de fenilamonio y luego oxidando, primero con clorato de sodio\(\left( \ce{NaClO_3} \right)\) y finalmente con dicromato de sodio\(\left( \ce{Na_2Cr_2O_7} \right)\). El negro de anilina probablemente no es una sola sustancia, y no se conoce su (s) estructura (s) exacta (s); pero su formación ciertamente implica reacciones de adición en las que se hacen enlaces carbono-nitrógeno. Se muestra una posible estructura en la que hay siete unidades de anilina:
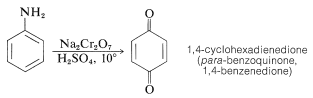
La oxidación de bencenamina con dicromato de sodio en solución acuosa de ácido sulfúrico produce 1,4-ciclohexadienodiona (para -benzoquinona), que es el miembro más simple de una interesante clase de dicetonas cíclicas conjugadas que se discutirán con más detalle en el Capítulo 26:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


