25.4: Análisis de Aminoácidos
- Page ID
- 72569
La ninhidrina y pruebas relacionadas
En muchos tipos de investigación es importante contar con medios simples y sensibles para el análisis de aminoácidos, particularmente en pequeñas cantidades. La detección de aminoácidos se puede lograr fácilmente mediante la “prueba de color de ninhidrina”, mediante la cual una solución alcohólica de la tricetona, “ninhidrina”, se calienta con un aminoácido y produce un intenso color azul-violeta. La sensibilidad y confiabilidad de esta prueba es tal que 0.1 micromol de aminoácido da una intensidad de color reproducible a un poco por ciento, siempre que esté presente un agente reductor como el cloruro estañoso para evitar la oxidación de la sal coloreada por el oxígeno disuelto.

La reacción de formación de color es interesante porque la mayoría\(\alpha\) de los aminoácidos dan el mismo color independientemente de su estructura. \(^4\)La secuencia de pasos que lleva al color es la siguiente:

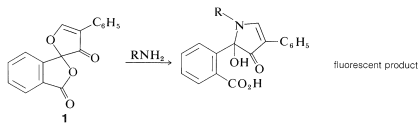
Un nuevo método muy sensible de detección y análisis de aminoácidos, que es útil hasta el nivel de\(10^{-12}\) moles (picomoles), depende de la formación a partir de\(\ce{RNH_2}\) y “fluorescamina”\(1\), de sustancias que son intensamente fluorescentes en la luz ultravioleta:
Cromatografía en Papel
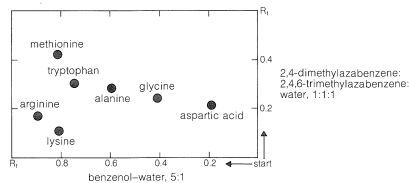
La ninhidrina (o fluorescamina) es muy útil en métodos cromatográficos para el análisis de aminoácidos. Una de ellas es la cromatografía en papel, donde los aminoácidos se separan como consecuencia de diferencias en sus coeficientes de reparto entre agua y un disolvente orgánico. La fase acuosa se mantiene estacionaria en los poros del papel debido a la fuerte interacción del agua con las funciones hidroxilo de la celulosa. Las diferencias en los coeficientes de partición se muestran como diferencias en las tasas de migración en la superficie de papel húmedo (pero no húmedo) sobre el cual hay un flujo lento de un disolvente orgánico saturado de agua. Discutiremos uno de varios modos de operación útiles. En este ejemplo, se coloca una gota de la solución a analizar en la esquina de una hoja de papel húmedo (a menudo papel de filtro), que luego se coloca en un aparato como el de la Figura 25-2, dispuesto de manera que el disolvente orgánico pueda migrar hacia arriba por capilaridad a través del papel, llevando los aminoácidos con él a lo largo de un borde. Los ácidos que tienen mayor solubilidad en el disolvente orgánico se mueven más rápidamente y cuando el disolvente alcanza la parte superior del papel, el papel se retira, se seca y luego se gira lateralmente, y se permite que un disolvente diferente migre hacia arriba. Este proceso de doble migración da una mejor separación de los aminoácidos que una sola migración y da como resultado la concentración de los diferentes aminoácidos en manchas bastante bien definidas. Estas manchas se pueden hacer visibles primero secando y luego rociando el papel con solución de ninhidrina. El resultado final es como se muestra en la Figura 25-3 y por lo general es bastante reproducible bajo un conjunto dado de condiciones. Las identidades de los aminoácidos que producen las diversas manchas se establecen en comparación con el comportamiento de mezclas conocidas.
El análisis por cromatografía en capa fina (ver Sección 9-2B) se puede realizar de la misma manera que la cromatografía en papel. El reparto es ahora entre una fase estacionaria sólida (el recubrimiento sobre la placa) y el frente de disolvente móvil.
Cromatografía de intercambio iónico
El advenimiento de la cromatografía de intercambio iónico ha revolucionado la separación y el análisis de aminoácidos así como el de muchas sustancias inorgánicas. Como su nombre lo indica, implica el intercambio de iones entre una fase estacionaria y una fase móvil. La fase estacionaria es un polímero insoluble (o resina) que tiene cadenas en las que se localizan funciones iónicas tales como grupos sulfonato,\(\ce{-SO_3^-}\) o grupos amonio cuaternario,\(\ce{-} \overset{\oplus}{\ce{N}} \ce{R_3}\). Los contraiones a estos grupos, tales como\(\ce{Na}^\oplus\) o\(\ce{Cl}^\ominus\), no están unidos a la resina y pueden intercambiarse por otros iones en la fase móvil a medida que la fase móvil viaja a través de la resina. Una aplicación común de este principio es en los ablandadores de agua domésticos, en los que los iones calcio y magnesio en el agua “dura” ordinaria son reemplazados por iones de sodio de la resina (Ecuación 25-3). El agua “blanda” resultante puede liberarse de iones metálicos, si se desea, intercambiando los\(\ce{Na}^\oplus\) iones por protones (Ecuación 25-4):
\[2 \left( \text{resin} \ce{-SO_3^-} \ce{Na^+} \right)+ \ce{Ca^{2+}} \rightleftharpoons 2 \left( \text{resin} \ce{-SO_3^-} \right) \ce{Ca^{2+}} + 2 \ce{Na^+} \tag{25-3}\]
\[\text{resin} \ce{-SO_3^-} \ce{H^+} \rightleftharpoons \text{resin} \ce{-SO_3^-} \ce{Na^+} + \ce{H^+} \tag{25-4}\]
En soluciones fuertemente ácidas (pH\(\sim 0\)), los grupos amina y carboxilo de un aminoácido están completamente protonados. Esta forma catiónica del aminoácido puede intercambiarse con los cationes asociados con los grupos sulfonato de la resina:
\[\text{resin} \ce{-SO_3^-} \ce{Na^+} + \ce{H_3} \overset{+}{\ce{N}} \ce{CRHCO_2H} \rightleftharpoons \text{resin} \ce{-SO_3^-} \ce{H_3} \overset{+}{\text{N}} \ce{CRHCO_2H} + \ce{Na^+} \tag{25-5}\]
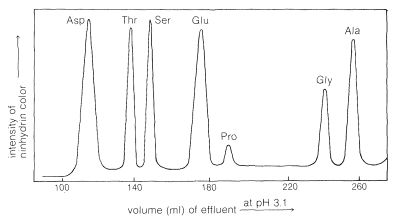
El proceso es reversible, y los cationes de aminoácidos pueden a su vez intercambiarse fuera de las columnas. Sin embargo, diferentes aminoácidos tienen diferentes afinidades por la resina, y estos están considerablemente influenciados por el pH de la fase móvil (eluyente). Los aminoácidos básicos (arginina, lisina), que forman cationes más fácilmente, están más fuertemente retenidos por las resinas de intercambio catiónico que los aminoácidos ácidos (ácidos aspártico y glutámico). Existe un espectro de afinidades de los otros cationes de aminoácidos por la resina entre estos extremos. Así, una mezcla de aminoácidos se puede separar por cromatografía de intercambio iónico mediante elución con soluciones acuosas tamponadas. El efluente de la columna se mezcla con solución de ninhidrina y se mide la intensidad del color azul y se grafica en función del tiempo a caudales constantes (Figura 25-4). La identidad de un aminoácido está determinada por el volumen de disolvente requerido para eluir el aminoácido de la columna, y la concentración se determina a partir de la intensidad del color desarrollado.
\(^4\)Prolina e hidroxiprolina son excepciones porque ninguno tiene el\(\ce{NH_2}\) grupo primario necesario para la reacción. Sin embargo, estos compuestos reaccionan con la ninhidrina para dar compuestos amarillos, y estos colores pueden usarse para identificarlos satisfactoriamente.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


