25.5: Reacciones de Aminoácidos
- Page ID
- 72667
Formación de éster y amida
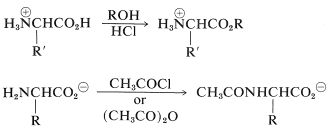
En cierto grado las reacciones de los aminoácidos son típicas de las funciones aisladas de ácido carboxílico y amina. Así, la función carboxilo puede esterificarse con un exceso de un alcohol en condiciones ácidas, y la función amina puede acilarse con cloruros o anhidridos de ácido en condiciones básicas:
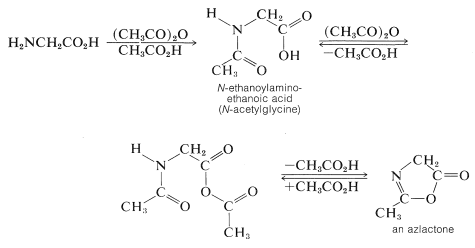
Los productos, sin embargo, no son indefinidamente estables porque los grupos funcionales pueden, y eventualmente lo harán, reaccionar entre sí. Por ejemplo, en la acilación de glicina con anhídrido etanoico, el primer producto formado puede ciclarse a la “azlactona” si la reacción es prolongada o se usa anhídrido en exceso:
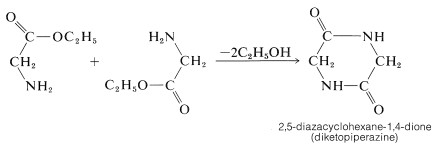
Los ésteres de aminoácidos también se ciclan, pero lo hacen intermolecularmente para dar “dicetopiperazinas”. Estos compuestos son amidas cíclicas:
Reacción de ácido nitroso
La función amina de\(\alpha\) -aminoácidos y ésteres reacciona con el ácido nitroso de una manera similar a la descrita para las aminas primarias (Sección 23-10A). El intermedio ion diazonio pierde nitrógeno molecular en el caso del ácido, pero el éster de diazonio pierde un protón y forma un compuesto diazo relativamente estable conocido como diazoetanoato de etilo:
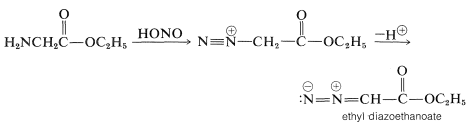
Este diazo éster se forma porque la pérdida\(\ce{N_2}\) del ion diazonio da como resultado la formación de un carbocatión bastante desfavorable.
Aminoácidos con Aldehídos
\(\alpha\)-Los aminoácidos reaccionan con aldehídos para formar productos de descarboxilación y/o desaminación. La secuencia de reacción se muestra en la Figura 25-5 y se asemeja mucho a la reacción de ninhidrina (Sección 25-4A). En la primera etapa la amina se condensa con el aldehído para dar una imina o base de Schiff,\(2\). Lo que sucede a continuación depende de las tasas relativas de desplazamiento de protones y descarboxilación de\(2\). El desplazamiento de protones produce una imina reordenada\(3\), que puede hidrolizarse al cetoácido\(4\). El cetoácido es un producto de desaminación. Alternativamente, la descarboxilación puede ocurrir (ver Sección 18-4) y la imina resultante,\(5\), puede hidrolizarse o reorganizarse mediante un desplazamiento de protones a una nueva imina,\(6\). La hidrólisis de\(5\) o\(6\) da un aldehído y una amina.
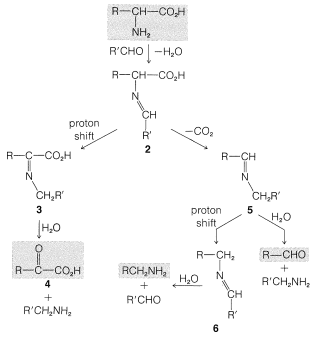
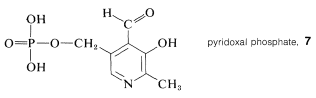
Existe una contraparte bioquímica importante de la reacción de desaminación que utiliza fosfato de piridoxal,\(7\), como el aldehído. Cada paso en la secuencia es catalizado por una enzima específica. El grupo\(\alpha\) -amino del aminoácido se combina con\(7\) y se convierte en un cetoácido. La piridoxamina resultante reacciona para formar una imina con un\(\alpha\) -cetoácido diferente, dando como resultado la formación de un nuevo\(\alpha\) aminoácido y regenerándose\(7\). El proceso general se muestra en la Ecuación 25-6 y se denomina transaminación. Es una parte clave del proceso mediante el cual se metabolizan los aminoácidos.
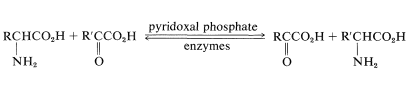 \(\tag{25-6}\)
\(\tag{25-6}\)
El proceso bioquímico ocurre con la preservación completa de la\(L\) configuración en el\(\alpha\) carbono. Las mismas reacciones se pueden llevar a cabo no enzimáticamente usando fosfato de piridoxal, pero no son estereoespecíficas, requieren iones metálicos como catalizador, y dan mezclas de productos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


