25.9: Enzimas
- Page ID
- 72694
Prácticamente todas las reacciones bioquímicas son catalizadas por proteínas llamadas enzimas. El poder catalítico y especificidad de las enzimas es extraordinariamente alto. Las reacciones que catalizan son generalmente mejoradas en velocidad de muchos órdenes de magnitud, a menudo tanto como\(10^7\), a lo largo del proceso no enzimático. En consecuencia, las reacciones enzimáticas pueden ocurrir en condiciones mucho más suaves que las reacciones de laboratorio comparables. Por ejemplo, la hidrólisis simple de una amida procede a una velocidad práctica solo al calentar la amida en una solución acuosa fuertemente ácida o fuertemente básica, e incluso entonces la reacción puede no estar completa durante varias horas. Por el contrario, la hidrólisis de enlaces amida o peptídicos catalizada por enzimas proteolíticas típicas, como la tripsina, la quimotripsina o la carboxipeptidasa A, ocurre rápidamente como temperaturas fisiológicas y pH fisiológico. \(^7\)Es uno de los atributos notables de muchas enzimas que catalizan reacciones que de otro modo requerirían condiciones fuertemente ácidas o básicas. Las enzimas son estrictamente catalizadores, sin embargo, y afectan solo a la velocidad de reacción, no a la posición de equilibrio; disminuyen la energía del estado de transición, no las energías de los reactivos o productos (ver Figura 4-4).
Muchas enzimas parecen estar hechas a medida para una reacción específica que involucra solo un reactivo, que se llama sustrato. Otros pueden funcionar más generalmente con diferentes reactivos (sustratos). Pero no existe tal cosa como una enzima universal que haga todas las cosas por todos los sustratos. Sin embargo, nada parece dejarse al azar; incluso el equilibrio del dióxido de carbono con el agua se logra con la ayuda de una enzima conocida como anhidrasa carbónica. \(^8\)Claramente, el alcance de la química enzimática es enorme, sin embargo, la estructura y función de relativamente pocas enzimas se entienden en detalle. Podemos dar aquí solo una breve discusión sobre los mecanismos de acción enzimática - primero algunos principios generales luego algunos ejemplos específicos.
Aspectos de los Mecanismos de Reacciones Enzimas
Una enzima generalmente cataliza una sola operación química en una posición muy específica, lo que significa que solo una pequeña parte de la enzima está íntimamente involucrada. La región de la estructura enzimática donde ocurren reacciones clave como resultado de la asociación del sustrato con la enzima se denomina sitio activo. La asociación inicial de la enzima\(\left( \ce{E} \right)\) y el sustrato\(\left( \ce{S} \right)\) es la formación de un complejo enzima-sustrato\(\left( \ce{ES} \right)\):
\[\ce{E} + \ce{S} \rightleftharpoons \ce{ES}\]
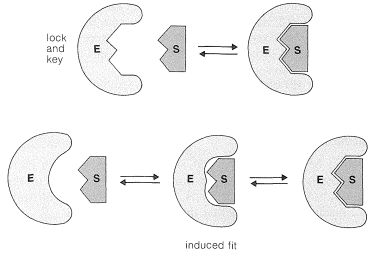
La complejación puede ocurrir de muchas maneras diferentes, pero para la complejación íntima requerida para la catálisis, la enzima debe tener, o debe ser capaz de asumir, una forma complementaria a la del sustrato. Originalmente, se creía que el sustrato encajaba la enzima algo así como una llave en una cerradura; este concepto ha sido modificado en los últimos años a la teoría del ajuste inducido, por lo que la enzima puede adaptarse para ajustarse al sustrato mediante cambios conformacionales (Figura 25-18). Alternativamente, el sustrato puede inducirse de manera similar para que se ajuste a la enzima. La complementariedad es tridimensional, un factor importante para determinar la especificidad de las enzimas a la estructura y configuración estereoquímica de los sustratos.
Las estructuras detalladas para los sitios activos de las enzimas son difíciles de obtener y se han elaborado solo para unas pocas enzimas que han sido ampliamente estudiadas por métodos químicos y de rayos X. Se ha obtenido información muy reveladora mediante estudios de difracción de rayos X de complejos entre la enzima y no sustratos, que son moléculas similares a los sustratos reales y complejos con la enzima en el sitio activo, pero que no reaccionan más. Estas sustancias a menudo inhiben la reacción del sustrato normal al asociarse fuertemente con la enzima en el sitio activo y no avanzar hacia los productos. Los estudios de rayos X de enzimas complejadas con no sustratos muestran que el sitio activo generalmente es una hendidura o cavidad en la estructura plegada de la enzima que es en gran parte de carácter hidrófobo. Se puede inferir que el complejo enzima-sustrato se mantiene unido en gran medida por fuerzas de atracción de van der Waals entre grupos similares (Sección 12-3C), enlaces de hidrógeno y por atracción electrostática entre grupos iónicos o polares. Para lograr una reacción catalizada estereoespecífica, debe haber al menos tres puntos de tales interacciones para alinear adecuadamente el sustrato dentro de la cavidad de la enzima.
La reacción del\(\ce{ES}\) complejo puede convertir el sustrato en producto\(\left( \ce{P} \right)\) directamente, y simultáneamente liberar la enzima\(\left( \ce{E} \right)\) para que reaccione con más sustrato:
\[\ce{ES} \rightarrow \ce{P} + \ce{E}\]
Sin embargo, la reacción entre la enzima y el sustrato a menudo es mucho más compleja. En muchos casos, el sustrato se une covalentemente a la enzima. Luego, en una etapa o etapas posteriores, el sustrato unido a enzima\(\left( \ce{ES'} \right)\) reacciona para dar productos y regenerar la enzima activa\(\left( \ce{E} \right)\):
\[\ce{ES} \rightarrow \ce{ES'} \rightarrow \ce{P} + \ce{E}\]
Carboxipeptidasa A
El considerable detalle al que ahora podemos entender la catálisis enzimática está bien ilustrado por lo que se sabe sobre la acción de la carboxipeptidasa A. Esta enzima (Sección 25-7B y Tabla 25-3) es una de las enzimas digestivas del páncreas que hidrolizan específicamente los enlaces peptídicos en el\(\ce{C}\) -extremo terminal. Se conocen tanto la secuencia de aminoácidos como la estructura tridimensional de la carboxipeptidasa A. La enzima es una sola cadena de 307 residuos de aminoácidos. La cadena tiene regiones donde se asocia como una\(\alpha\) hélice y otras donde se asocia como una lámina\(\beta\) plisada. El grupo protésico es un ion zinc unido a tres aminoácidos específicos y una molécula de agua cerca de la superficie de la molécula. Los aminoácidos unidos al zinc son His 69, His 196 y Glu 72; la numeración se refiere a la posición del aminoácido a lo largo de la cadena, siendo el aminoácido en el\(\ce{N}\) extremo el número 1. El ion zinc es esencial para la actividad de la enzima y está implicado, por lo tanto, como parte del sitio activo.
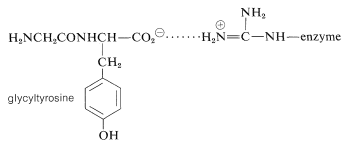
Los estudios\(^9\) de rayos X de carboxipeptidasa complejada con gliciltirosina (con la que reacciona solo lentamente) proporcionan una descripción detallada del sitio activo, que se muestra esquemáticamente en la Figura 25-19a y se explica a continuación.
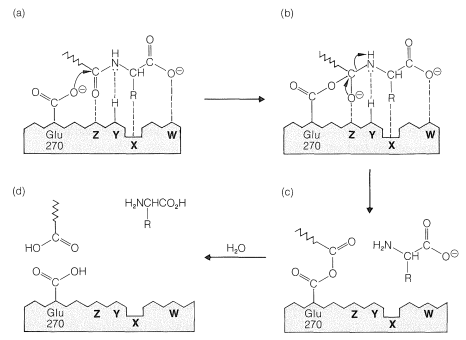
1. El grupo carboxilato de tirosina del sustrato está asociado por atracción electrostática con la cadena lateral cargada positivamente de arginina 145\(\left( \ce{W} \right)\):
2. La cadena lateral tirosina del sustrato se asocia con una bolsa no polar en la enzima\(\left( \ce{X} \right)\).
3. Posiblemente se produce un enlace de hidrógeno entre el par no compartido de amida de tirosina sustrato y los\(\ce{HO}\) grupos de cadena lateral de la enzima tirosina 248\(\left( \ce{Y} \right)\).
4. El oxígeno glicil carbonilo en el sustrato probablemente se coordina con el ion zinc\(\left( \ce{Z} \right)\), desplazando la molécula de agua coordinada al zinc en la enzima no complejada.
5. Un anión carboxilato de cadena lateral del ácido glutámico 270 está tan situado con respecto al centro de reacción que bien podría funcionar como un nucleófilo atacando el carbono de glicina carbonilo.
La disposición del complejo enzima-sustrato sugiere un mecanismo de reacción plausible análogo a los mecanismos no enzimáticos de hidrólisis de amida (Sección 24-4). El grupo carboxilo de Glu 270 puede agregarse a la amida carbonilo para formar un intermedio tetraédrico que luego se disocia rápidamente para liberar el aminoácido terminal, dejando el resto del sustrato unido a la enzima como un anhídrido mixto que puede simbolizarse como\(\ce{E(CO)OCOR_1}\). La reacción del intermedio acil-enzima con agua liberará el péptido, menos el aminoácido terminal, y regenera la enzima.
Esta secuencia postulada de eventos puede dejarle preguntándose por qué la enzima acelera la hidrólisis, especialmente porque la secuencia procede a través de una reacción energéticamente desfavorable, la formación de un anhídrido carboxílico a partir de una amida y un ácido carboxílico:
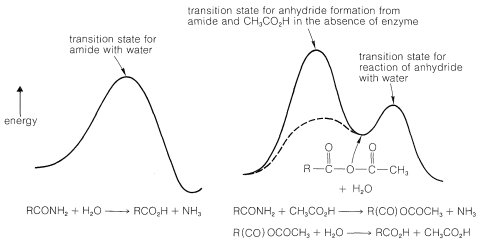
Entonces, ¿cómo podemos esperar que la enzima pueda hacer que la ruta del anhídrido sea más rápida que la simple ruta del agua? La respuesta es la forma en que las interacciones en el complejo enzima-sustrato pueden estabilizar el estado de transición para la reacción formadora de anhídrido. Así, para la carboxipeptidasa el zinc puede actuar como un fuerte electrófilo para facilitar el ataque a la amida carbonilo. Los enlaces de hidrógeno del nitrógeno amida a Tyr 248 facilitarán el ataque al grupo carbonilo y ayudarán a romper el\(\ce{C-N}\) enlace. Además, el ambiente no polar de las cadenas laterales alquílicas de la enzima incrementará la nucleofilia del\(\ce{-CO_2^-}\) grupo que forma el anhídrido (ver Sección 8-7F). La inspección de la Figura 25-20 muestra cualitativamente que si la energía del estado de transición para la formación del anhídrido se baja mucho, ¡la tasa general estará determinada por la velocidad de hidrólisis del anhídrido! En esta circunstancia (suponiendo que la hidrólisis del anhídrido no esté catalizada), la eficiencia de la enzima para romper el enlace peptídico es tan grande como puede ser, al menos por esta vía particular de hidrólisis peptídica. Tales eficiencias se han establecido para otras enzimas.
Participación de Serina en Acción Enzimática
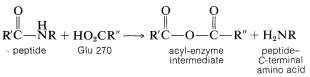
Mecanismos similares al descrito para la carboxipeptidasa parecen operar en la hidrólisis de enlaces amida y éster catalizados por una serie de proteinasas y esterasas. El sustrato, aquí generalizado como\(\ce{RCOX}\), actúa para acilar la enzima, que posteriormente reacciona con agua para dar los productos observados:
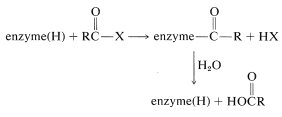
En la etapa de acilación un grupo nucleófilo en una de las cadenas laterales de aminoácidos en el sitio activo se comporta como el nucleófilo. Como hemos visto en la Sección 25-9B, el nucleófilo de la carboxipeptidasa es el grupo carboxilo libre del ácido glutámico 270. En varias otras enzimas (quimotripsina, subtilisina, tripsina, elastasa, trombina, acetilcolinesterasa), es el grupo hidroxilo de un residuo de serina:
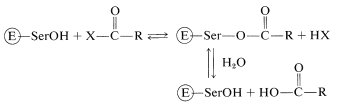
Esto plantea otra pregunta. ¿Por qué el serina hidroxilo es un nucleófilo efectivo cuando el agua y otros compuestos hidroxílicos claramente no son igualmente efectivos? Aparentemente, la nucleofilia de la serina\(\ce{-CH_2OH}\) se ve potenciada por la catálisis ácido-base que implica transferencias de protones entre las funciones ácidas y básicas de la cadena lateral en las proximidades del sitio activo. Se cree que la serina transfiere su\(\ce{OH}\) protón a un\(^{10}\) sitio anfótero\(\ce{B-A-H}\) en la enzima en el mismo instante en que el protón de\(\ce{B-A-H}\) se transfiere a otra base\(\ce{B'}^\ominus\) (Ecuación 25-8). Estas transferencias de protones son, por supuesto, reversibles:
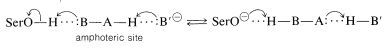 \(\tag{25-8}\)
\(\tag{25-8}\)
La pérdida de su protón hace que el oxígeno de serina hidroxilo sea un nucleófilo mucho más potente, y aunque el equilibrio de la Ecuación 25-8 debe estar muy a la izquierda a pH fisiológico, puede aumentar en gran medida la reactividad del hidroxilo de serina.
En quimotripsina y subtilisina, este sistema de red de retransmisión de carga, como se le llama, está compuesto por un residuo específico de ácido aspártico, que actúa como\(\ce{B'}^\ominus\), y un residuo específico de histidina (que actúa como anfótero\(\ce{B-A-H}\)):
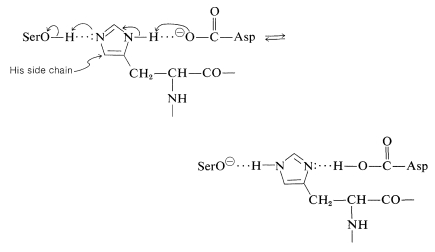
\(^7\)La lentitud con la que se hidrolizan los enlaces amida en presencia de ácidos fuertes o bases fuertes, y su susceptibilidad a la hidrólisis bajo la influencia de enzimas, es claramente una ventaja clave en el funcionamiento biológico de los péptidos. La hidrólisis de amida en solución neutra tiene una constante de equilibrio favorable, pero no grande. Por lo tanto, no se necesita mucha energía bioquímica ni para formar ni para hidrolizar enlaces peptídicos. La resistencia a la hidrólisis ordinaria proporciona la estabilidad necesaria para las proteínas, y sin embargo, cuando es necesario romper los enlaces peptídicos de las proteínas, como en la digestión, esto se puede hacer de manera suave y eficiente con la ayuda de las enzimas proteolíticas.
\(^8\)Muchas enzimas se nombran agregando el sufijo -asa a una palabra, o palabras, descriptivas del tipo de actividad enzimática. Así, las esterasas hidrolizan ésteres, las proteinasas hidrolizan proteínas, las reductasas logran reducciones y las sintetasas logran la síntesis de cadenas polipeptídicas, cadenas de ácido nucleico y otras moléculas.
\(^9\)W. N. Lipscomb, Cuentas de Investigación Química 3, 81 (1970); E. T. Kaiser y B. L. Kaiser, ibid. 5, 219 (1972). Lipscomb recibió el Premio Nobel de Química 1976 por trabajo estructural en boranos.
\(^{10}\)Anfótero significa que una sustancia puede actuar ya sea como un ácido o como una base.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


