25.8: Estructura y Función de las Proteínas
- Page ID
- 72679
Las funciones biológicas de las proteínas son extremadamente diversas. Algunas actúan como hormonas que regulan diversos procesos metabólicos. Un ejemplo es la insulina, que regula los niveles de azúcar en sangre. Las enzimas actúan como catalizadores de reacciones biológicas, y otras proteínas sirven como materiales estructurales biológicos, por ejemplo, colágeno y elastina en el tejido conectivo y queratina en el cabello. Las proteínas que contienen hierro (hemoglobina y mioglobina en mamíferos) y las proteínas que contienen cobre (hemocianinas en mariscos) transportan oxígeno molecular. Algunas proteínas sanguíneas forman anticuerpos, que proporcionan resistencia a enfermedades, mientras que las llamadas nucleoproteínas son constituyentes importantes de los genes que suministran y transmiten información genética en la división celular. El movimiento por medio de la contracción muscular y la generación y transmisión de impulsos nerviosos también involucran proteínas.
¿Cómo puede un grupo de compuestos, hecho de un conjunto de aminoácidos de base común, ser tan notablemente heterogéneo y exhibir funciones tan variadas pero específicas? Claramente, la estructura primaria y la presencia o ausencia de grupos funcionales especiales, metales, etc., son de suma importancia. De importancia complementaria son las estructuras tridimensionales de las proteínas, las cuales están dictadas no solo por la estructura primaria sino por la forma en que la estructura primaria se articula bioquímicamente. Las cadenas polipeptídicas son raramente, si cada una completamente extendida, pero se enrollan y se pliegan en conformaciones más o menos estables. Como resultado, las cadenas laterales de aminoácidos en posiciones distantes en la secuencia lineal se acercan muy cerca, y esta yuxtaposición a menudo es crucial para que la proteína cumpla con su función biológica específica.
Estructura tridimensional de las proteínas
La elucidación de la forma detallada de las moléculas de proteína -de hecho, las ubicaciones espaciales de los átomos individuales en una proteína- se logra principalmente mediante cristalografía de rayos X. Las estructuras tridimensionales de más de veinte proteínas se han establecido ahora por esta técnica. La importancia de la cristalografía de rayos X para la química estructural y biológica ha sido reconocida en la concesión de seis premios Nobel en esta área. \(^6\)Una serie de proteínas importantes y sus propiedades se enumeran en la Tabla 25-3.
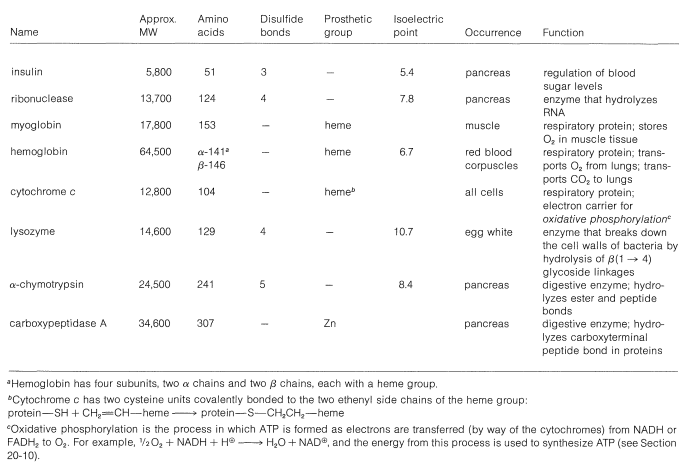
Cuadro 25-3: Algunas proteínas importantes de estructura conocida
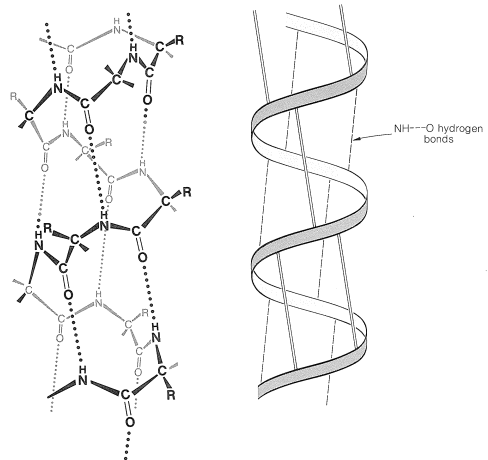

Hay varios otros puntos para notar sobre la\(\alpha\) hélice que se muestra en la Figura 25-11. Los grupos amida son planos y normalmente conservan la configuración trans estable en la estructura helicoidal; las longitudes de enlace y los ángulos de enlace son normales y los enlaces de\(\ce{-NH} \cdots \ce{O=C}-\) hidrógeno son casi lineales. Sin embargo, los enlaces de hidrógeno no son del todo paralelos al eje largo del serpentín, por lo que hay 3.6 en lugar de 4 unidades de aminoácidos por giro helicoidal, y el espaciamiento entre vueltas es aproximadamente\(5.4 \: \text{Å}\). La\(\alpha\) hélice en las proteínas tiene giros diestros como una rosca de tornillo a la derecha.
Los aminoácidos de las cadenas laterales se encuentran fuera de la espiral de la\(\alpha\) hélice y están muy cerca de las cadenas laterales separadas por tres y cuatro unidades de aminoácidos. Debido a esta proximidad, el impedimento estérico entre cadenas laterales grandes puede ser suficiente para reducir la estabilidad de la\(\alpha\) hélice normal. Cuando se produce tal obstáculo, hay una discontinuidad en la estructura helicoidal, y la cadena peptídica puede asumir disposiciones más aleatorias alrededor de los\(\ce{N-C}_\alpha\) enlaces\(\ce{C-C}_\alpha\) y (ver Figura 25-12), permitiendo así que la molécula se pliegue sobre sí misma y forme nuevos enlaces de hidrógeno. La estructura helicoidal aparentemente siempre se interrumpe en los residuos de prolina o hidroxiprolina porque los\(\ce{N-C}_\alpha\) enlaces de estos aminoácidos no son libres de rotar (se incorporan en anillos de cinco miembros) y también porque los nitrógenos de prolina e hidroxiprolina amida no tienen hidrógenos en los que participar enlaces de hidrógeno a grupos carbonilo.
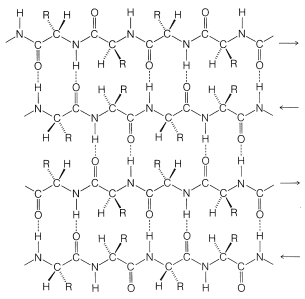
Pauling y Corey reconocieron una segunda conformación estable de cadenas polipeptídicas, la cadena extendida o lámina\(\beta\) plisada (Figura 25-13). En esta conformación las cadenas están completamente extendidas con configuraciones trans amida. En esta disposición se maximiza la distancia entre cadenas laterales de aminoácidos adyacentes. Los enlaces de hidrógeno del tipo\(\ce{-N-H} \cdots \ce{O=C}-\) se encuentran ahora entre cadenas en lugar de entre aminoácidos en una sola cadena (como en la\(\alpha\) hélice). Este tipo de estructura no es tan común como la\(\alpha\) hélice y se encuentra extensamente solo en la fibroína de seda. Sin embargo, una serie de proteínas con una sola cadena polipeptídica pueden formar secciones cortas de láminas\(\beta\) plisadas “antiparalelas” plegándose sobre sí mismas, como se ilustra en la Figura 25-14.
Otro factor muy importante en la arquitectura proteica es el\(\ce{-S-S}-\) enlace disulfuro. Las partes remotas de la cadena polipeptídica pueden mantenerse juntas a través del acoplamiento oxidativo de dos grupos tiol de cisteína para formar un puente disulfuro:
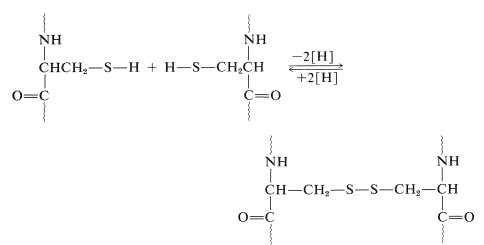
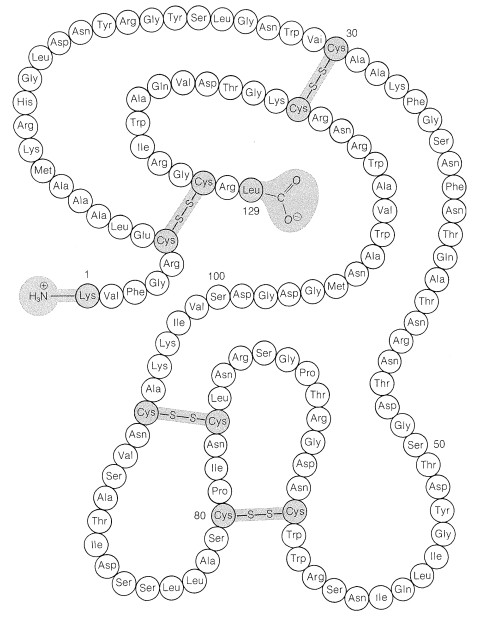
Los puentes disulfuro en algunas proteínas se encuentran entre diferentes cadenas peptídicas. La insulina, por ejemplo, tiene dos\(\ce{S-S}\) puentes intercadena así como uno intracadena (Figura 25-8).
Mioglobina y Hemoglobina
Se puede obtener alguna idea de la complejidad de las conformaciones proteicas a partir de la estructura de la mioglobina. Esta proteína es responsable del almacenamiento y transporte de oxígeno molecular en el tejido muscular de los mamíferos. Es una molécula compacta de 153 unidades de aminoácidos en una cadena que está extensamente enrollada como una\(\alpha\) hélice. Hay ocho regiones de discontinuidad en la estructura helicoidal, y en estas regiones la cadena se pliega sobre sí misma como se muestra en la Figura 15-16. Cuatro de las ocho regiones no helicoidales ocurren en los residuos de prolina; la razón de la discontinuidad en las otras regiones no es del todo clara. Con la excepción de dos unidades de histidina, las regiones interiores de la mioglobina acomodan solo las cadenas laterales no polares; el interior, por lo tanto, es principalmente hidrocarbonado y repelente al agua y otras moléculas polares. En contraste, las cadenas laterales polares están en el exterior de la proteína.
Varias proteínas, incluyendo la mioglobina, poseen uno o más componentes no peptídicos asociados con sitios específicos en la cadena polipeptídica. Estos componentes se denominan grupos protésicos y son esenciales para la actividad biológica. Cuando se elimina el grupo protésico, la proteína residual se denomina apoproteína.
En la mioglobina el grupo protésico es una molécula de hemo. El grupo hemo pertenece a una clase de compuestos interesantes llamados metaloporfirinas, que son complejos metálicos de un sistema de anillos altamente conjugado compuesto por cuatro anillos de azaciclopentadieno (pirrol) unidos por\(\ce{-CH=}\) puentes entre las posiciones 2 y 5. El compuesto parental se conoce como porfina. Las porfirinas tienen estados excitados electrónicos altamente estabilizados y absorben la luz visible. Como resultado suelen ser compuestos de colores brillantes (e.g., clorofila, Figura 20-6).
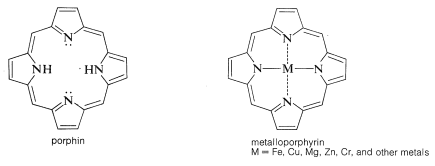
La porfirina del hemo se conoce como protoporfirina IX, y el metal asociado es el hierro [como\(\ce{Fe}\) (II) o\(\ce{Fe}\) (III)]. Notará que el anillo de porfirina lleva cadenas laterales de metilo, etenilo y ácido propanoico:
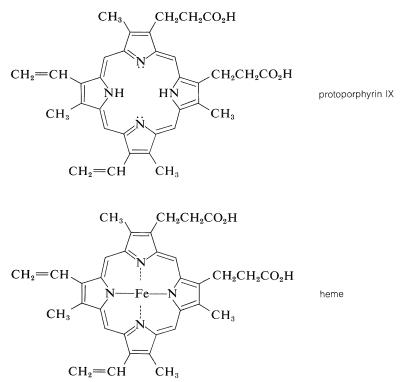
Un gran esfuerzo por parte de varios químicos eminentes a principios de siglo condujo a la elucidación de la estructura del hemo. El químico alemán Hans Fischer sintetizó con éxito el hemo en 1929, hazaña por la que, en 1930, recibió el Premio Nobel de Química. [Algunos años antes (1915), Richard Willstatter recibió el Premio Nobel por estudios estructurales de clorofila y pigmentos vegetales.]
Una pregunta muy importante es, ¿cómo la combinación particular de proteína e hierro-porfirina permite que la mioglobina se una reversiblemente al oxígeno molecular? La respuesta a esta pregunta no se conoce en todos sus detalles, pero está bien establecido que\(\ce{Fe}\) (II) -porfirinas se complejarán fácil y reversiblemente con el oxígeno. Hay dos sitios de coordinación adicionales alrededor del hierro en el hemo además de los cuatro nitrógenos del anillo. Estos se indican a continuación como los ligandos generales\(\ce{L}\):
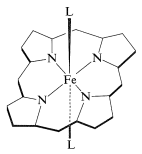
La molécula de hemo disclike encaja en una hendidura en la estructura de la proteína y se une a ella a través de uno de los sitios de\(\ce{L}\) coordinación a un nitrógeno de histidina. El sitio de coordinación restante en el otro lado del anillo está ocupado por oxígeno molecular. En ausencia de la coordinación por histidina, el hierro porfirina se oxidaría rápidamente al estado férrico, el cual no se une al oxígeno.
Se han sintetizado varios compuestos modelo que tienen anillos de\(\ce{Fe}\) (II) -porfirina portando una cadena lateral con histidina dispuesta para poder coordinarse con el metal en un lado. Varias de estas sustancias se muestran prometedoras como portadores de oxígeno con propiedades similares a la mioglobina.
La hemoglobina está relacionada con la mioglobina tanto en su estructura como en su función. Se une reversiblemente al oxígeno molecular que transporta en los corpúsculos rojos de la sangre en lugar de en el tejido muscular. Sin embargo, la hemoglobina está compuesta por cuatro cadenas polipeptídicas, en contraste con la mioglobina que tiene una sola cadena. Dos de las cadenas de hemoglobina son de un tipo con 141 residuos de aminoácidos, llamadas las\(\alpha\) cadenas, y dos son de otro tipo con 146 aminoácidos, llamadas las\(\beta\) cadenas. Cada cadena, o subunidad, contiene un grupo hemo idéntico al hemo en la mioglobina. Las subunidades se mantienen en la hemoglobina por interacciones no covalentes y proporcionan cuatro hemos y por lo tanto cuatro sitios de unión para oxígeno molecular. Los\(\beta\) hemos\(\alpha\) y los hemos tienen diferentes afinidades por el oxígeno pero funcionan de manera cooperativa para aumentar la disponibilidad de oxígeno en las células.
A pesar de que\(\beta\) las cadenas\(\alpha\) y de la hemoglobina son no idénticas con la cadena de mioglobina, las estructuras tridimensionales de las tres cadenas son sorprendentemente similares; las mioglobinas y hemoglobinas difieren ligeramente en la composición de aminoácidos, dependiendo de la especie pero la proteína la forma sigue siendo esencialmente la misma.
Estructuras cuaternarias de proteínas
Muchos factores contribuyen a las estructuras tridimensionales de las proteínas. Ya hemos mencionado enlaces de hidrógeno entre grupos amida, ubicación y carácter de grupos protésicos y enlaces disulfuro. Otras influencias importantes incluyen interacciones electrostáticas entre grupos iónicos (\(\ce{-NH_3^+}\),\(\ce{-CO_2^-}\)), enlaces de hidrógeno que implican sustituyentes\(\left( \ce{-CH_2OH} \right)\) de cadena lateral e interacciones no enlazadas. Excepto por los enlaces disulfuro, la mayoría de estas interacciones son débiles en comparación con las fuerzas de enlace covalente, y las conformaciones de muchas proteínas pueden alterarse con bastante facilidad. De hecho, varios tienen conformaciones que claramente se encuentran en equilibrio dinámico bajo condiciones fisiológicas. Dicha flexibilidad estructural puede ser necesaria para que la proteína sea funcional, pero si la conformación se altera irreversiblemente -es decir, si se desnaturaliza- su actividad biológica suele ser destruida.
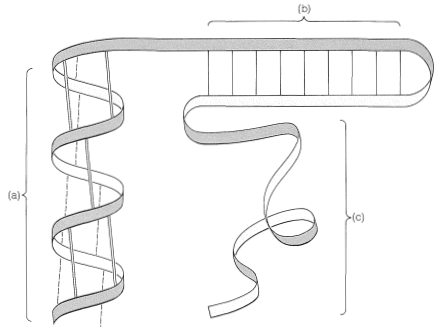
En muchos casos existen interacciones importantes entre moléculas proteicas que pueden conducir a estructuras altamente organizadas como la lámina plisada de fibroína de seda (Figura 25-13) o el enrollamiento de\(\alpha\) hélices, como se encuentra en\(\alpha\) -queratinas, las proteínas fibrosas del cabello, cuerno y músculos (Figura 25-17). Este tipo de organización de moléculas proteicas se llama estructura cuaternaria y es una característica importante de muchas proteínas que se asocian en dímeros, tetrámeros, etc. La estructura tetramérica de la hemoglobina es un ejemplo importante.
\(^6\)Los siguientes premios Nobel recibieron sus premios por contribuciones al uso de la cristalografía de rayos X para la determinación de la estructura: 1914, Max von Laue (física), difracción de rayos X en cristales; 1915, William Bragg y Lawrence Bragg (física), estudio de la estructura cristalina mediante rayos X; 1954, Linus Pauling (química), estudio de estructura de proteínas; 1962, Max Perutz y John Kendrew (química), estructuras de mioglobina y hemoglobina; 1962, Francis Crick, James Watson, y Maurice Wilkins (fisiología y medicina), doble hélice de ADN; 1964, Dorothy Hodgkin (química), determinación de estructura de vitamina B\(_{12}\) y penicilina por métodos de rayos X. Posteriormente determinó la estructura tridimensional de la insulina.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


