26.2: Quinonas
- Page ID
- 73689
Las quinonas no son compuestos aromáticos sino dicetonas cíclicas conjugadas. Sin embargo, es conveniente discutir su química en este punto porque las quinonas y los arenoles aromáticos relacionados se interconvierten fácilmente, y su química es en gran medida interdependiente.
Se han preparado una variedad de estructuras similares a quinonas, las más comunes de las cuales son las 1,2- y 1,4-quinonas ejemplificadas por las 1,2- y 1,4-bencenodionas. Por lo general, las 1,2-quinonas son más difíciles de elaborar y son más reactivas que las 1,4-quinonas. También se conocen algunas 1,6- y 1,8-quinonas.
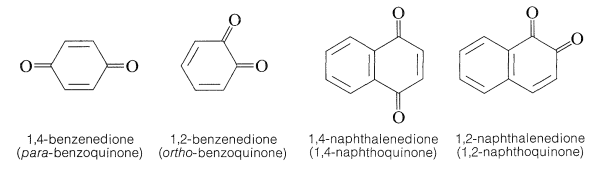
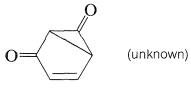
No se conocen 1,3-quinonas, posiblemente porque tendrían estructuras no planares, muy tensas y por lo tanto serían inestables:
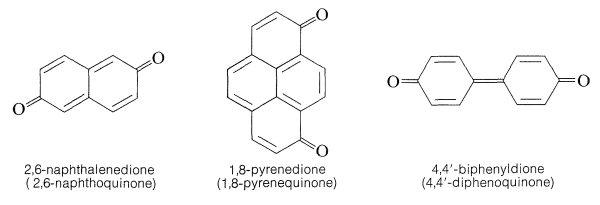
Se conocen varias quinonas en las que la disposición de quinonas se extiende sobre más de un anillo. Los ejemplos son:
Reducción de Quinonas
Una reacción característica e importante de las quinonas es la reducción a los arenodioles correspondientes. Los productos de reducción de 1,4-quinonas se denominan hidroquinonas:
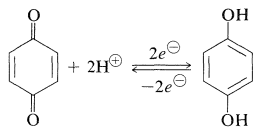 \(\tag{26-2}\)
\(\tag{26-2}\)
La reducción se puede lograr electroquímicamente y con una variedad de agentes reductores (metales en ácido acuoso, hidrogenación catalítica). Tales reducciones son inusuales entre las reacciones orgánicas por ser suficientemente rápidas y reversibles para dar potenciales de electrodo fácilmente reproducibles en una celda electrolítica. La posición del equilibrio 1,4-bencenodiol-1,4, -bencenodiona (Ecuación 26-2) es proporcional al cuadrado de la concentración de iones hidrógeno. Por lo tanto, el potencial del electrodo es sensible al pH; un cambio de una unidad de pH en la solución de agua cambia el potencial del electrodo por\(0.059 \: \text{V}\). Antes de la invención del medidor de pH de electrodo de vidrio, el potencial de media celda desarrollado por este equilibrio se utilizó ampliamente para determinar los valores de pH de las soluciones acuosas. El método no es muy útil por encima de pH 9 debido a que la quinona reacciona irreversiblemente con álcali.
Se han realizado numerosos estudios sobre la relación entre los potenciales de reducción de media célula y las estructuras de las quinonas. Como cabría esperar, los potenciales son mayores cuando la estabilización de resonancia asociada con la formación del anillo aromático es mayor.
Cuando se mezclan soluciones de alcoholes de hidroquinona y quinona, se desarrolla un color marrón-rojo y cristaliza un complejo verde-negro 1:1 que se conoce como quinhidrona. Esta sustancia es un complejo de transferencia de carga (Sección 24-6C), con el diol actuando como donador de electrones y la diona como aceptor de electrones. La quinhidrona no es muy soluble y se disocia considerablemente a sus componentes en solución.
La reducción de una quinona requiere de dos electrones, y es posible que estos electrones puedan transferirse ya sea juntos o uno a la vez. El producto de una transferencia de un solo electrón conduce a lo que apropiadamente se llama una semiquinona\(1\),, con una carga negativa y un electrón impar (un anión radical):
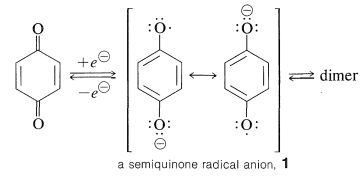
La formación de radicales semiquinonas relativamente estables por reducción electrolítica de quinonas se ha establecido por una variedad de métodos. Algunos radicales semiquinona experimentan reacciones de dimerización reversibles para formar peróxidos.
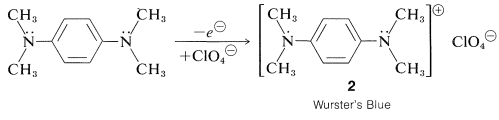
Un radical catión particularmente estable del tipo semiquinona se forma por oxidación suave de\(\ce{N}\),\(\ce{N}\)\(\ce{N'}\),\(\ce{N'}\) -tetrametil-1,4-bencenodiamina. El catión, que es aislable como una sal de perclorato azul brillante\(2\), se llama “Wurster's Blue”:
Quinonas de Importancia Biológica
La oxidación y reducción en los sistemas bioquímicos implica muchas reacciones que son similares a la pareja arenodiol-arenediol. Hemos mencionado varios anteriormente:\(\ce{NADP}^\oplus \rightleftharpoons \ce{NADPH}\) (Sección 20-9), y\(\ce{FADH_2} \rightleftharpoons \ce{FAD}\) (Sección 15-6C).
Una cuestión importante en la oxidación metabólica es cómo la reducción del oxígeno\(\left( \frac{1}{2} \ce{O_2} + 2 \ce{H}^\oplus + 2 \ce{e} \rightarrow \ce{H_2O} \right)\) está ligada a la oxidación de\(\ce{NADH}\)\(\left( \ce{NADH} \rightarrow \ce{NAD}^\oplus + \ce{H}^\oplus + 2 \ce{e} \right)\). La ruta para la transferencia de electrones del\(\ce{NADH}\) oxígeno (oxidación más fosforilación; Sección 20-10) es indirecta, complicada e implica, en una etapa temprana, la oxidación del mononucleótido\(\ce{NADH}\) por flavina\(\left( \ce{FMN} \right)\) por la reacción\(\ce{FMN} + \ce{NADH} + \ce{H}^\oplus \rightarrow \ce{FMNH_2} + \ce{NAD}^\oplus\). Pero la forma reducida de\(\ce{FMN}\),\(\ce{FMNH_2}\), no reacciona directamente con el oxígeno. En cambio, reduce una quinona llamada coenzima Q (CoQ) al arenediol correspondiente:
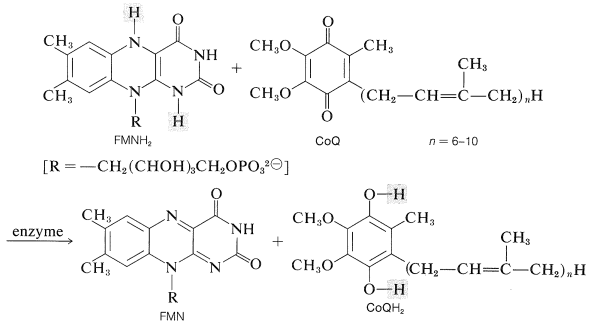
El efecto de esta etapa es formar un reductor ligeramente polar (CoQ\(\ce{H_2}\)) a partir de un reductor fuertemente polar\(\left( \ce{FMNH_2} \right)\), y esto permite que el material reducido penetre en una región menos polar del aparato oxidativo. La CoQ reducida no reacciona directamente con el oxígeno, sino que participa en una cadena de reacciones de oxidación-reducción que implican transferencia de electrones entre varias proteínas que contienen hierro conocidas como citocromos. Al final de esta cadena de reacción, la forma reducida de un citocromo que contiene cobre reacciona realmente con el oxígeno. La secuencia de portadores de electrones puede resumirse como
\[\ce{NADH} \rightarrow \ce{FMNH_2} \rightarrow \textbf{CoQ}\ce{H_2} \rightarrow \text{cytochromes} \rightarrow \ce{O_2}\]
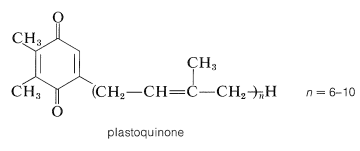
Un proceso relacionado ocurre en la fotosíntesis (Sección 20-9). Recordarás que una parte crítica de la fotosíntesis implica la transferencia de electrones del fotosistema que oxida el agua\(\left( \ce{H_2O} \rightarrow \frac{1}{2} \ce{O_2} + 2 \ce{H}^\oplus + 2 \ce{e} \right)\) al fotosistema que reduce\(\ce{NADP}^\oplus\)\(\left( \ce{NADP}^\oplus + 2 \ce{H}^\oplus + 2 \ce{e} \rightarrow \ce{NADPH} + \ce{H}^\oplus \right)\). Al igual que en la fosforilación oxidativa, la ruta de transferencia de electrones es compleja. Sin embargo, uno de los portadores de electrones es una quinona llamada plastoquinona que se asemeja mucho a la coenzima Q que se encuentra en animales. La plastoquinona, como la coenzima Q, se reduce a la forma de hidroquinona, que es parte de una cadena de transporte de electrones que involucra proteínas que contienen hierro y cobre:
Entre otras sustancias naturales que tienen estructuras tipo quinona, una de las más importantes es el factor antihemorrágico sanguíneo, la vitamina K\(_1\), que se presenta en las plantas verdes y es una 1,4-naftalenodiona sustituida:
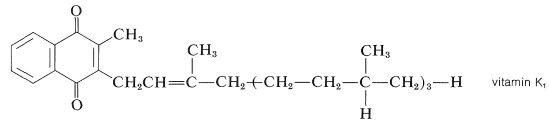
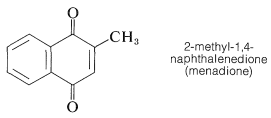
La estructura de la vitamina K se\(_1\) ha establecido por degradación y por síntesis. Sorprendentemente, la cadena lateral alquílica larga de la vitamina K no\(_1\) es necesaria para su acción en la coagulación de la sangre debido a que la 2-metil-1,4-naftoquinona es casi igualmente activa sobre una base molar.
Además de desempeñar un papel vital en los procesos de oxidación-reducción de organismos vivos, las quinonas se presentan ampliamente como pigmentos naturales que se encuentran principalmente en plantas, hongos, líquenes, organismos marinos e insectos (ver alizarina, Sección 28-4A, como representante de un tinte natural tipo antraquinona).
Desarrolladores Fotográficos
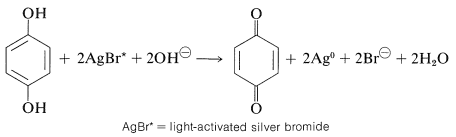
La fotografía hace un uso práctico importante del sistema de oxidación-reducción de arenodiol. La exposición de los granos diminutos de bromuro de plata en una emulsión fotográfica a la luz azul (o cualquier luz visible en presencia de tintes sensibilizantes adecuados) produce una forma activada estable de bromuro de plata, la activación implica la generación de algún tipo de defecto cristalino. Posteriormente, cuando la emulsión se pone en contacto con un revelador, que puede ser una solución acuosa alcalina de 1,4-bencenodiol (hidroquinona) y sulfito de sodio, las partículas de bromuro de plata activado se reducen a metal plateado mucho más rápidamente que el bromuro de plata ordinario. La eliminación del bromuro de plata no reducido con tiosulfato de sodio (“fijación”) deja una suspensión de plata finamente dividida en la emulsión en forma del familiar negativo fotográfico.
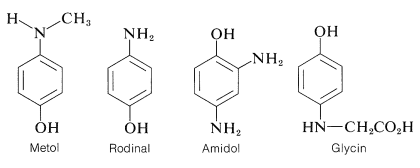
Una variedad de compuestos se utilizan como agentes de revelado fotográfico. No todos son arenodioles. De hecho, la mayoría son aminoalcoholes aromáticos o diaminas, pero independientemente de sus diferencias estructurales, todos poseen la capacidad de sufrir reacciones redox del tipo descrito para el 1,4-bencenodiol. Las fórmulas estructurales y los nombres comerciales para varios desarrolladores importantes son
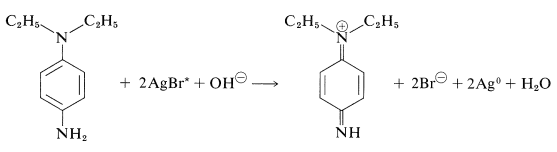
La 1,4-Bencenodiamina también es un agente de desarrollo efectivo, pero puede causar dermatitis en individuos sensibles. \(\ce{N}\),\(\ce{N}\) -Dietil-1,4-bencenodiamina se utiliza como desarrollador en fotografía a color. Estas sustancias reaccionan con bromuro de plata para producir derivados de bencenodiamina:
Reacciones de adición de quinonas
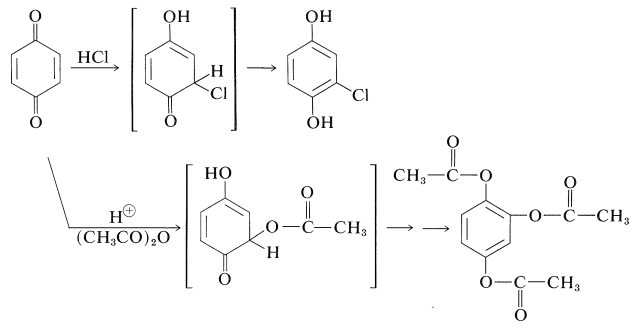
Al ser\(\alpha\) cetonas\(\beta\) -insaturadas, las quinonas tienen el potencial de formar productos de 1,4-adición de la misma manera que sus análogos de cadena abierta (Sección 17-5B). La 1,4-bencenodiona se somete a tales adiciones con bastante facilidad. Los productos son inestables y se someten a enolización para dar 1,4-bencenodioles sustituidos. Dos ejemplos son la adición de cloruro de hidrógeno y la adición catalizada por ácido de anhídrido etanoico. En esta última reacción, los grupos hidroxilo del aducto son acilados por el anhídrido. La hidrólisis del producto produce 1,2,4-bencenotriol:
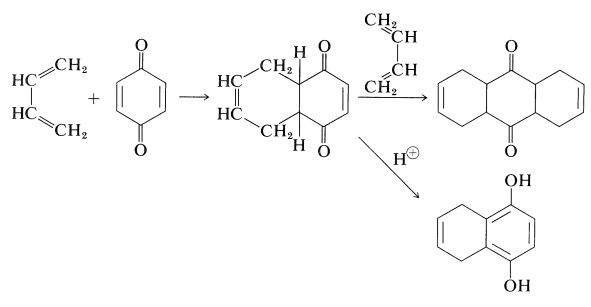
Las quinonas generalmente se someten fácilmente a adiciones de Diels-Alder, siempre que tengan al menos un doble enlace que no sea parte de un anillo aromático. Con 1,4-bencenodiona y 1,3-butadieno, se puede obtener el mono- o diaducto. El monoaducto se enoliza bajo la influencia de ácido o base a un derivado de 1,4-bencenodiol:
Quinonas de Ciclobutadieno
Las benzoquinonas deben sus propiedades inusuales como\(\alpha\) cetonas\(\beta\) insaturadas a la facilidad con la que se transforman en sistemas aromáticos estables. ¿Cómo cambiarían estas propiedades si la quinona se derivara de estructuras no aromáticas, como ciclobutadieno, ciclooctatetraeno o pentaleno? No hay una respuesta definitiva a esta pregunta porque se han preparado pocas sustancias de este tipo, siendo las más conocidas hasta ahora las mono- y difenilciclobutenodionas:
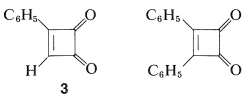
Por ejemplo, se\(3\) puede preparar a partir de la hidrólisis con ácido sulfúrico del producto de cicloadición de etinilbenceno y trifluorocloroeteno (Sección 13-3D):
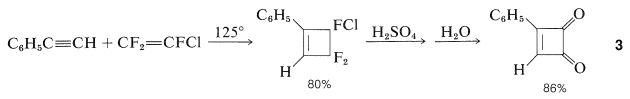
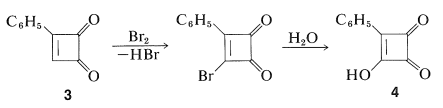
La diona,\(3\), es un sólido cristalino amarillo que, a pesar de su tenso anillo de cuatro miembros, es mucho menos reactivo que la 1,2-bencenodiona (orto-benzoquinona). No se puede reducir a un ciclobutenodiol, no experimenta reacciones de Diels-Alder, y con bromo da un producto de sustitución en lugar de adición. El compuesto bromo así formado se hidroliza rápidamente a un compuesto hidroxi\(4\), que es un ácido extraordinariamente fuerte que tiene una constante de ionización aproximadamente\(10^9\) veces la del bencenol:
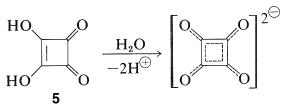
También se ha preparado un compuesto relacionado, 3,4-dihidroxi-1,2-ciclobutenodiona\(5\), y es un ácido dibásico muy fuerte. A veces se le llama “ácido escuárico”:
De los datos disponibles hasta el momento, parece que las quinonas correspondientes al ciclobutadieno tienen más carácter aromático que los propios ciclobutadienos.
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


