26.4: Algunos Compuestos Aromáticos de Cadena Lateral
- Page ID
- 73690
Hemos discutido en este capítulo y en capítulos anteriores cómo se modifica la reactividad de los sustituyentes halógeno, amino e hidroxi cuando se unen a carbonos aromáticos en lugar de a carbonos saturados. Otros sustituyentes, particularmente aquellos unidos a un anillo aromático a través de un enlace carbono-carbono, también están influenciados por el anillo, aunque usualmente en menor grado. Los ejemplos incluyen\(\ce{-CH_2OH}\)\(\ce{-CH_2OCH_3}\),\(\ce{-CH_2Cl}\),,\(\ce{-CHO}\)\(\ce{-COCH_3}\), y\(\ce{-CO_2H}\), y\(\ce{-CN}\), y nos referiremos a compuestos aromáticos que contienen sustituyentes de este tipo como compuestos aromáticos de cadena lateral. Nuestro interés en tales compuestos se dirigirá principalmente a reacciones en la cadena lateral, con particular referencia al efecto del anillo aromático sobre la reactividad. En este sentido, discutiremos los cationes, aniones y radicales triarilmetilo relativamente estables, así como la correlación cuantitativa de las tasas de reacciones orgánicas por lo que se conoce como la ecuación de Hammett.
Preparación de compuestos aromáticos de cadena lateral
Los ácidos carboxílicos se pueden obtener de la mayoría de los alquilbencenos por oxidación de la cadena lateral con reactivos tales como permanganato de potasio, dicromato de potasio o ácido nítrico:
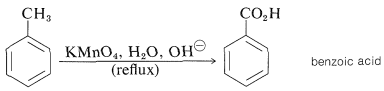
Bajo las condiciones de oxidación, los grupos alquilo o alquenil superiores se degradan y los sustituyentes del anillo, distintos de los grupos halógeno y nitro, a menudo no logran sobrevivir. Como ejemplo, la oxidación de 5-nitro-2-indanona con ácido nítrico diluido conduce a ácido 4-nitro-1,2-bencenodicarboxílico:
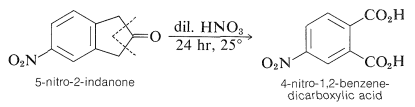
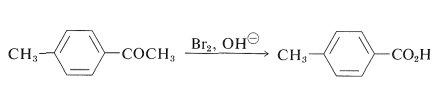
Para retener un sustituyente de cadena lateral, se requieren métodos selectivos de oxidación. Por ejemplo, el ácido 4-metilbenzoico se puede preparar a partir de 1- (4-metilfenil) etanona mediante la reacción de haloforma (Sección 17-2B):
Muchos compuestos halógenos de cadena lateral pueden sintetizarse mediante reacciones que también son aplicables a haluros de alquilo (ver tabla 14-5), pero existen otros métodos especialmente útiles para la preparación de haluros de arilmetilo. Los más importantes de estos son la clorometilación de compuestos aromáticos (que se discutirán más adelante en esta sección) y la halogenación radical de alquilbencenos.
Se discutió previamente la cloración radical inducida por la luz o la bromación de alquilbencenos con cloro molecular o bromo (Sección 14-3C). En estas condiciones, el metilbenceno reacciona con cloro para dar sucesivamente fenilclorometano, fenildiclorometano y feniltriclorometano:
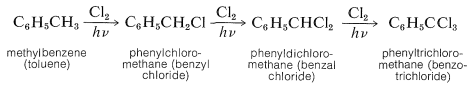
Las reacciones relacionadas ocurren con otros reactivos, notablemente cloruro de sulfurilo,\(\ce{SO_2Cl_2}\) hipoclorito de terc - butilo,\(\ce{(CH_3)_3COCl}\) y\(\ce{N}\) -bromobutanimida,\(\ce{(CH_2CO)_2NBr}\). La\(\alpha\) sustitución de alquilbencenos es el resultado de reacciones radicales-cadena (Sección 14-3C).
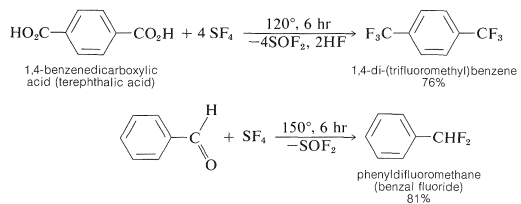
Compuestos de flúor de cadena lateral con las agrupaciones\(\ce{-CHF_2}\)\(\ce{-CF_2}-\), y\(\ce{-CF_3}\) están disponibles por reacción de tetrafluoruro de azufre o hexafluoruro de molibdeno con compuestos de carbonilo (ver Sección 16-4D):
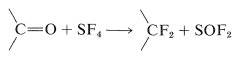
A continuación se presentan algunos ejemplos específicos:
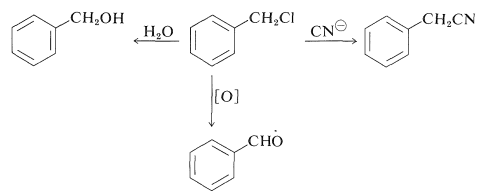
Los cloruros o bromuros de arilmetilo son compuestos bastante reactivos que están fácilmente disponibles o se preparan fácilmente, y como resultado son intermedios útiles para la síntesis de otros derivados de cadena lateral. Así, el cloruro de fenilmetilo puede hidrolizarse a fenilmetanol, convertirse en feniletanitrilo con cianuros de metales alcalinos y oxidarse a bencenocarbaldehído (benzaldehído):
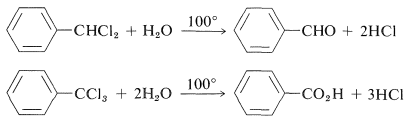
El fenildiclorometano se hidroliza fácilmente a benzaldehído, y el feniltriclorometano a ácido benzoico:
Las cadenas laterales de carbono también se pueden introducir por sustitución directa y varias de tales reacciones se han discutido en detalle previamente. Estas incluyen la alquilación y acilación de Friedel-Crafts (Sección 22-4E y 22-4F), la reacción de Gattermann-Koch para la preparación de aldehídos a partir de arenos y monóxido de carbono (Sección 22-4F), y las reacciones de Kolbe-Schmitt, Reimer-Tiemann y Gattermann para la síntesis de ácidos y aldehídos de arenoles (Sección 26-1E).
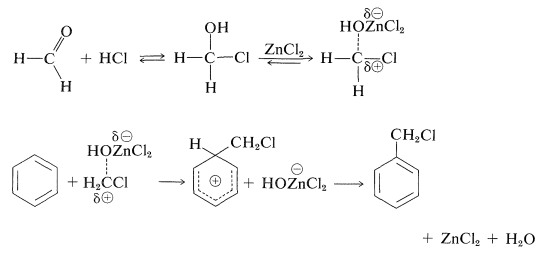
La clorometilación es un método útil\(\ce{-CH_2Cl}\) para la sustitución de un hidrógeno aromático, siempre que se inicie con un areno razonablemente reactivo. Los reactivos son metanol y cloruro de hidrógeno en presencia de cloruro de zinc:
\[\ce{C_6H_6} + \ce{CH_2O} + \ce{HCl} \overset{\ce{ZnCl_2}}{\longrightarrow} \ce{C_6H_5CH_2Cl} + \ce{H_2O}\]
El mecanismo de la reacción de clorometilación está relacionado con el de la alquilación y acilación de Friedel-Crafts y probablemente involucra un catión clorometilo incipiente,\(^\oplus \ce{CH_2Cl}\):
Cationes Triarilmetilo
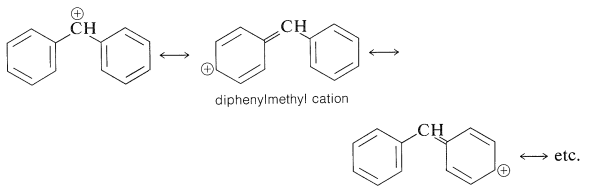
Los haluros de fenilmetilo son similares en\(S_\text{N}1\) reactividad a los haluros de 2-propenilo. La\(S_\text{N}1\) reactividad de los derivados de fenilmetilo puede atribuirse principalmente a la estabilización del catión por deslocalización electrónica. Los haluros de difenilmetilo\(\ce{(C_6H_5)_2CHX}\), son aún más reactivos y esto es razonable porque el catión difenilmetilo tiene dos grupos fenilo sobre los cuales se puede deslocalizar la carga positiva y, por lo tanto, debe ser más estable en relación con el haluro de partida que el catión fenilmetilo:
En consecuencia, podríamos esperar que los haluros de trifenilmetilo (o tritilo)\(\ce{(C_6H_5)_3C-X}\), sean aún más reactivos. De hecho, los\(\ce{C-X}\) enlaces de tales compuestos son extremadamente lábiles. En el dióxido de azufre líquido, los haluros de triarilmetilo se ionizan reversiblemente, aunque los equilibrios se complican por la asociación de pares de iones:
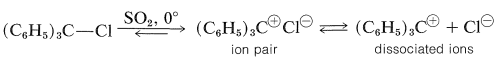
Los cationes triarilmetilo se encuentran entre los carbocationes más estables conocidos. Son intensamente coloreados y se forman fácilmente cuando los triarilmetanoles correspondientes se disuelven en ácidos fuertes:
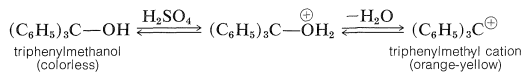
Aniones de triarilmetilo
Además de los cationes estables, los compuestos de triarilmetilo forman carbaniones estables. Debido a esto los hidrocarburos correspondientes son relativamente ácidos comparados con los alcanos simples. Reaccionan fácilmente con bases fuertes como la amida sódica, y los carbaniones resultantes, como los cationes, están intensamente coloreados:
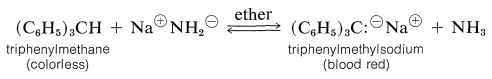
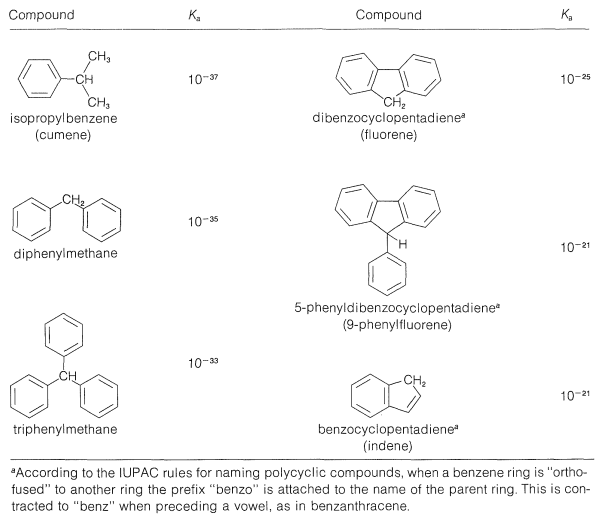
Las fuerzas ácidas de los arilmetanos se listan en el Cuadro 26-3. Todos son ácidos bastante débiles en relación con el agua pero varían a lo largo de muchos poderes de diez en relación entre sí. Los ácidos más fuertes forman los carbaniones más estables, y la estabilidad del carbanión generalmente está determinada por la efectividad con la que la carga negativa puede deslocalizarse sobre los grupos arilo sustituyentes.
Cuadro 26-3: Fortalezas de algunos ácidos hidrocarbonados
Radicales triarilmetilo
Los compuestos de triarilmetilo también forman radicales triarilmetilo bastante estables, y de hecho el primer radical libre de carbono estable que se reportó fue el radical trifenilmetilo\(\ce{(C_6H_5)_3C} \cdot\), preparado inadvertidamente por M. Gomberg en 1900. El objetivo de Gomberg fue preparar hexafeniletano mediante una reacción de acoplamiento de Wurtz de cloruro de trifenilmetilo con plata metálica:
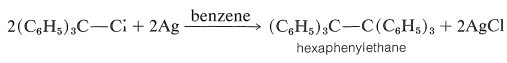
No obstante, encontró que a menos que se excluyera cuidadosamente el aire del sistema, el producto era peróxido de trifenilmetilo\(\ce{(C_6H_5)_3COOC(C_6H_5)_3}\), en lugar del hexafeniletano esperado.
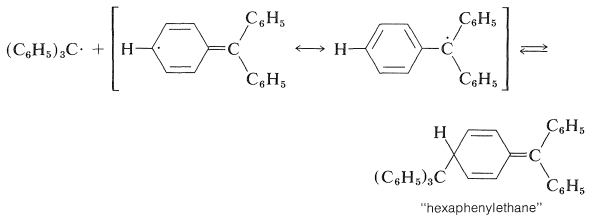
Gomberg consideró que la solución amarilla obtenida de la reacción de cloruro de trifenilmetilo con plata en benceno en ausencia de aire contenía el radical trifenilmetilo. Sin embargo, investigaciones posteriores mostraron que el peso molecular de la sustancia disuelta fue más cercano al del hexafeniletano.\(\ce{C_{38}H_{30}}\) Una amarga batalla se libró sobre la naturaleza del producto y sus reacciones. La controversia finalmente se resolvió por la demostración de que el hidrocarburo se\(\ce{C_{38}H_{30}}\) disocia rápidamente, pero solo ligeramente, a radicales trifenilmetilo a temperatura ambiente en disolventes inertes (\(K = 2.2 \times 10^{-4}\)at\(24^\text{o}\) en benceno). Durante muchos años después,\(\ce{C_{38}H_{30}}\) se creía que el hidrocarburo era el hexafeniletano. Ahora se sabe que esta conclusión era incorrecta. El producto es un dímero de trifenilmetilo, pero se forma por la adición de un radical a la posición 4 de un anillo fenilo del otro:
La formación del peróxido en presencia de oxígeno se explica de la siguiente manera:
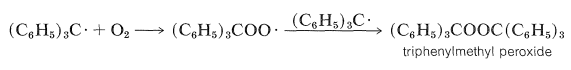
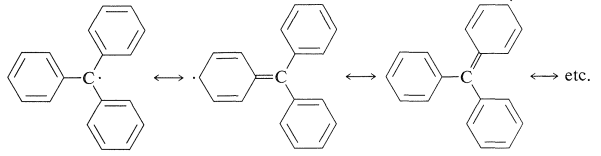
Si bien las reacciones anteriores que involucran al radical trifenilmetilo parecían muy irrazonables en el momento en que se descubrieron, la estabilidad del radical ahora se ha establecido más allá de toda duda por una variedad de métodos como la espectroscopia esr (Sección 27-9). Esta estabilidad se puede atribuir a la deslocalización del electrón impar sobre los grupos fenilo unidos:
Aldehídos aromáticos. La condensación de benjuí
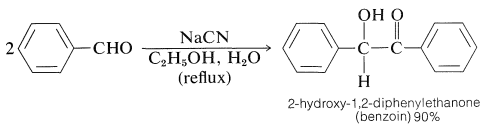
La mayoría de las reacciones de los aldehídos aromáticos\(\ce{ArCHO}\),, son las esperadas de aldehídos sin\(\alpha\) hidrógenos y la mayoría de estas no serán revisadas aquí. Una reacción que generalmente se considera característica de los aldehídos aromáticos (aunque, de hecho, sí ocurre con otros aldehídos que no tienen\(\alpha\) hidrógenos), se conoce como la condensación del benzoína. Esta reacción es esencialmente una dimerización de dos moléculas de aldehído a través de la acción catalítica del cianuro de sodio o potasio:
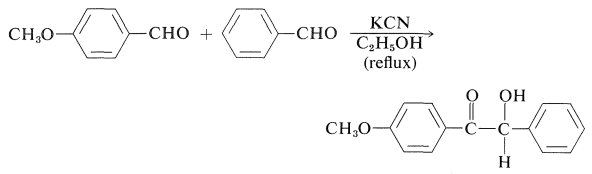
Se pueden obtener benzoínas asimétricas o mixtas con buen rendimiento a partir de dos aldehídos diferentes:
En cuanto al mecanismo de formación de benzoína, el ion cianuro se agrega al aldehído para formar\(12\). Este anión está en equilibrio con\(13\), donde la carga negativa puede deslocalizarse sobre los grupos fenilo y nitrilo. Una adición posterior de tipo aldol\(13\) al carbono carbonilo de una segunda molécula de aldehído da el producto de adición\(14\), y la pérdida\(\ce{HCN}\) de\(14\) conduce a la benzoína:
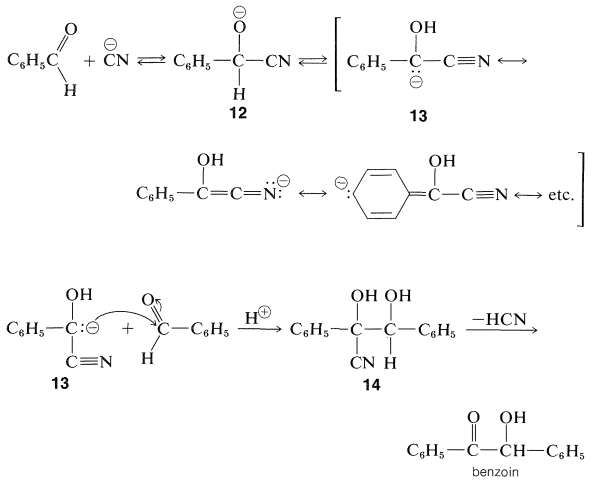
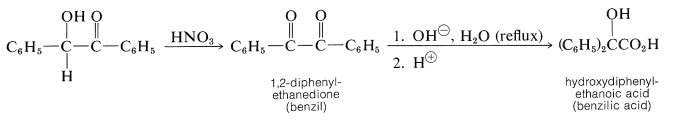
Las benzoínas son intermedios útiles para la síntesis de otros compuestos porque pueden oxidarse a 1,2-dionas y reducirse en etapas a diversos productos, dependiendo de las condiciones de reacción. La 1,2-dicetona conocida como bencilo, que se obtiene por oxidación de benzoína con ácido nítrico, se somete a un reordenamiento de hidratación catalizado por base para formar un\(\alpha\) -hidroxiácido, comúnmente llamado reordenamiento de ácido bencílico (ver Sección 17-7):
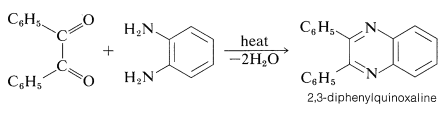
Los benzilos, al igual que otras 1,2-dionas, reaccionan con 1,2-bencenodiaminas para formar diazaarenos conocidos como quinoxalinas. Este tipo de reacción es un importante procedimiento general para la síntesis de sistemas de anillos aromáticos que contienen nitrógeno:
Colaboradores y Atribuciones
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."


